题目内容
【题目】某黑色固体粉末可能是 Fe、FeO、CuO、C 中一种或几种。为了探究其成分,小明同学按照下 图所示流程进行了实验。
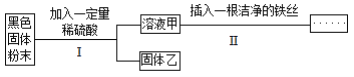
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定含有 Fe;
②若步骤Ⅱ中无明显现象,则固体乙中最多只能 有四种物质;
③若步骤Ⅱ中 有气泡产生,则原固体可能是纯净物也可能是混合物;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无 CuO;
⑤固 体乙呈红色,则原固体中一定含有 Fe 和 CuO。 以上说法中正确的个数是
A. 1 个 B. 2 个 C. 3 个 D. 4 个
【答案】B
【解析】由于C不与稀硫酸反应;氧化铜可以与稀硫酸反应,生成的Cu2+在水溶液中显蓝色;Fe可以与稀硫酸反应生成气体;Fe、FeO与硫酸反应生成的Fe2+在水溶液中显浅绿色;铁的活动性大于铜,能将铜从其盐溶液中置换出来。①若溶液甲呈浅绿色,则原黑色固体粉末中不一定含有Fe,FeO也可以与稀硫酸反应生成的Fe2+在水溶液中显浅绿色;故①错误;②若步骤Ⅱ中无明显现象,说明了溶液中无硫酸铜,没有剩余的硫酸,如果硫酸的量不足,则固体乙中最多可以有Fe、FeO、CuO、C、Cu五种物质,故②错误;③若步骤Ⅱ中有气泡产生,说明了硫酸是过量的,则固体乙可能含有铜,不一定是碳,则原固体可能是纯净物也可能是混合物,故③正确;④若步骤Ⅱ中有红色固体析出,说明了溶液中含有硫酸铜,能判断黑色粉末中含有CuO,不能判断固体乙中是否有CuO,故④错误;⑤固体乙呈红色,说明有铁置换出的铜,则原固体中一定含有Fe和CuO.故⑤正确;综合以上分析可知,B正确,故选B。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目