��Ŀ����
����Ŀ����������ͼ���漰��ƽ��ԭ����������أ� ��
A. ��ͼ��ʾ�����£���0.1mol?L��1��ˮ����HCl����ʱ����Һ������Ũ��������HCl�ı仯��ʵ�߱�ʾc��NH3?H2O�������߱�ʾc��NH
��ͼ��ʾ�����£���0.1mol?L��1��ˮ����HCl����ʱ����Һ������Ũ��������HCl�ı仯��ʵ�߱�ʾc��NH3?H2O�������߱�ʾc��NH ![]() ��������M��ʱ��Һ������
��������M��ʱ��Һ������
B. ��ͼ��ʾ2SO2��g��+O2��g��?2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ�����¶ȵı仯
��ͼ��ʾ2SO2��g��+O2��g��?2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ�����¶ȵı仯
C. ��ͼ��ʾ��Ӧ2NH3��g��?3H2��g��+N2��g�����ں��º�ѹװ���д�ƽ��ʱ��N2�����ʵ�����ͨ��NH3�����ʵ����ı仯��ϵ
��ͼ��ʾ��Ӧ2NH3��g��?3H2��g��+N2��g�����ں��º�ѹװ���д�ƽ��ʱ��N2�����ʵ�����ͨ��NH3�����ʵ����ı仯��ϵ
D. ��ͼ��ʾAgCl��s��?Ag+��aq��+Cl����aq�������ӵ�Ũ�ȹ�ϵ��������b��ʱ���������ֵ�ˮ���Ե���ƽ���ߵ�a�㴦
��ͼ��ʾAgCl��s��?Ag+��aq��+Cl����aq�������ӵ�Ũ�ȹ�ϵ��������b��ʱ���������ֵ�ˮ���Ե���ƽ���ߵ�a�㴦
���𰸡�C
���������⣺A������M��ʱ��Һ�а�ˮ��笠�����Ũ�Ⱦ�Ϊ0.05mol/L��һˮ�ϰ��ĵ���̶ȴ���笠����ӵ�ˮ��̶ȣ���Һ�Լ��ԣ���A����B����֪�÷�Ӧ������Ϊ���ȷ�Ӧ�������¶�ƽ�����ƣ�K��������С��K������ͼ����ʵ�ʲ�������B����
C�������������ʵ���ƽ�����ƣ����������ʵ�������ͼ����ʵ������ϣ���C��ȷ��
D���������ֵ�ˮ�������Ӻ�������Ũ�Ⱦ�����b�㵽a��������Ũ�Ȳ��䣬��D����
��ѡC��
�����㾫�������û�ѧƽ�ⳣ���ĺ�������������ˮ��Һ�еĵ���ƽ�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��ָ֪��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬����������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����

 һ����������ϵ�д�
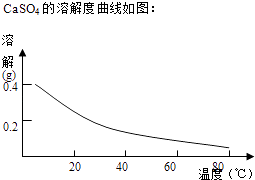
һ����������ϵ�д�����Ŀ��ͭ����������;�㷺�Ľ�������ҵ�����õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ����ս���ͭ����������ͼ�� 
��֪���������ʳ�����pH�����
Fe3+ | Cu2+ | Cr3+ | |
��ʼ����pH | 2.1 | 4.7 | 4.3 |
��ȫ����pH | 3.2 | 6.7 | a |
��ش��������⣺
��1����ҺI������������Ҫ�����ѧʽ����
��2���ڢڲ������У��ȼ���Ca��OH��2������Һ��pH�����ڷ�ΧΪ �� Ȼ����Һ������80����ȹ��ˣ�����������ijɷ�Ϊ ��
��3��������Ũ�ȡ�1��10��5molL��1ʱ��������Ϊ���ӳ�����ȫ���ڢܲ������У���ҪʹCr3+��ȫ����������������Һ��a����СֵΪ �� ����֪��Kap[Cr��OH��3]=6.3��10��31 �� ![]() ��4.0��lg4=0.6��
��4.0��lg4=0.6��
��4��Cr��OH��3���ȷֽ�ΪCr2O3 �� �����ȷ�����ұ����������д�����ȷ������Ļ�ѧ����ʽ ��
����Ŀ����֪���ױ���3��ͬ���칹�壬���ױ��б����ϵ�һ����ﹲ��6�֣����۵���±���
6��һ����ױ����۵�/�� | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
��Ӧ���ױ����۵�/�� | 13 | ��54 | ��27 | ��54 | ��27 | ��54 |
�ɴ��ƶ��۵�Ϊ234���һ����ױ������ǣ� ��
A.
B.
C.
D.