题目内容
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法不正确的是
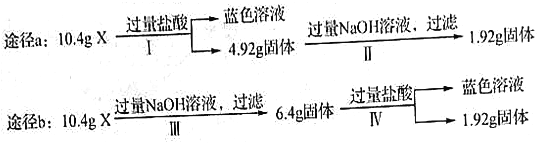
A. 由图可知X中可能存在Fe2O3 B. 可以判断混合物中是否含有Al2O3
C. 1.92g固体成分为Cu D. 依图可以计算Fe2O3和Cu的质量
【答案】A
【解析】A.取混合物10.4g,向其中加入过量的HCl,得到的溶液显蓝色,说明溶液中含有CuCl2,原固体中有Cu,由于Cu在金属活动性顺序表中排在H的后边,所以不能与酸发生反应,金属氧化物会发生反应,产生的盐与Cu发生反应,反应方程式是:Fe2O3+6HCl=2FeCl3+3H2O,然后发生反应:2FeCl3+Cu=2FeCl2+CuCl2,一定存在氧化铁,A错误;B.4.92g固体中加入过量NaOH溶液后还有剩余固体质量是1,92g,说明该固体是Cu,因此二氧化硅的质量是3g;在原固体中Fe2O3不足量,不能使Cu全部被Fe3+氧化为Cu2+;含有SiO2质量是3g;由于NaOH溶液可以与Al2O3、SiO2反应,实际溶解的质量是4.0g>3.0g,说明含有Al2O3;B正确;C.根据以上分析可知C正确;D.在10.4g固体中含有SiO23g;含有Al2O3的质量是4g-3g=1g;在加入酸溶解的质量(10.4—4.92)g=5.48g中,含有Al2O31g;则其余4.48g是Fe2O3和Cu,根据方程式Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2可得关系式:Fe2O3~Cu。160g Fe2O3对应64gCu,现在溶解质量是4.48g,因此含有Fe2O3的质量是3.2g,含有Cu的质量是1.28g,D正确。答案选A。

【题目】乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:CH3COOH+CH3CH2CH2CH20H ![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
制备过程中还可能有的副反应有
2CH3CH2CH2CH2OH ![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O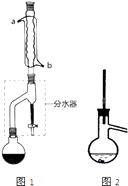
主要实验步骤如下:
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4 , 摇匀后,加几粒沸石,再按图1示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离与提纯:
①将烧瓶中反应后的混后物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/gmL﹣1 | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
根据以上信息回答下列问题:
(1)如图1整个装置可看作由分水器、圆底烧瓶和(填仪器名称)组成,其中冷水应从(填a或b)管口通入.
(2)如何判断该合成反应达到了终点: .
(3)在操作步骤①时,用右手压住分液漏斗的玻璃塞,左手握住将分液漏斗倒转过来,用力振荡,振摇几次后要放气,放气时支管口不能对着人和火.在操作步骤②后(即酯层用无水硫酸镁干燥后),应先(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在中加热比较合适(请从下列选项中选择).A.水 B.甘油(沸点290℃) C.砂子 D.石蜡油(沸点200~300℃)
如果蒸馏装置如图2所示,则收集到的产品中可能混有杂质.
(5)反应结束后,若放出的水为6.98mL(水的密度为1gmL﹣1),则正丁醇的转化率约为 .