题目内容
【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3
B. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
C. 若将CO2通入0.lmol/LNa2C03溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
D. 向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO)>c(0H-)
【答案】B
【解析】相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH可知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF。
A.酸的电离平衡常数从小到大顺序是:HClO<HF,在相同温度下,同浓度的酸溶液的导电能力顺序:HClO<HF,因酸性H2CO3>HClO,所以同浓度时导电性H2CO3>HClO,故A错误;B.ClO-+H2OHClO+OH-的水解平衡常数为K=![]() =
= ![]() =10-7.6,故B正确;C.溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),溶液呈中性,则c(H+)=c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)=0.2mol/L,故C错误;D.NAClO与HF反应后生成HClO,由于电离程度较弱,则c(HClO)>c(H+),故D错误;答案选B。
=10-7.6,故B正确;C.溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),溶液呈中性,则c(H+)=c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)=0.2mol/L,故C错误;D.NAClO与HF反应后生成HClO,由于电离程度较弱,则c(HClO)>c(H+),故D错误;答案选B。

【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:电池:Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)。电解池:2Al+3H2O![]() Al2O3+3H2↑,电解过程中,以下判断正确的是
Al2O3+3H2↑,电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb O2电极 | H+移向Pb电极 |
B | 每消耗3mol Pb | 生成2 mol Al2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
【题目】研究化学反应速率和化学反应限度具有重要意义。回答下列问题:
(Ⅰ)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL-1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL-1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL-1FeCl3溶液 |
(1)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进措施是_________________________________________。
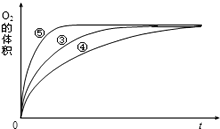
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析图能够得出的实验结论是__________________________________。
(Ⅱ)丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN等。
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①CH2=CHCH3(g)+NH3(g)+ 3/2 O2(g)→ CH2=CHCN(g)+3H2O(g) △H=-515 kJ/mol
②CH2=CHCH3(g)+ O2(g)→C3H4O(g)+H2O(g) △H=-353 kJ/mol
有利于提高丙烯腈平衡产率的反应条件是_______________;提高丙烯腈反应选择性的关键因素是__________。
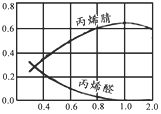
(2)丙烯腈和丙烯醛的产率与n(NH3)/n (丙烯)的关系如图所示。由图可知,最佳n(NH3)/n (丙烯)约为________,理由是________________。氨、丙烯、空气的进料理论体积比约为__________。