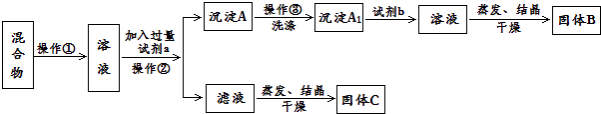
题目内容
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( ) 
A.该反应的化学方程式为3B+2D6A+4C
B.反应进行到1 s时,v(A)=3v(D)
C.反应进行到6 s时,B的平均反应速率为0.05mol/(Ls)
D.反应进行到6 s时,各物质的反应速率相等
【答案】BC
【解析】解:A、由图可知,反应达到平衡时A物质增加了1.0mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质了0.8mol,所以A、D为生成物,B、C为反应物,A、B、C、D物质的量之比为5:3:4:2,反应方程式为:3B+4C5A+2D,故A错误;
B、反应到1s时,v(A)= ![]() =
= ![]() =0.3mol/(Ls),v(D)=
=0.3mol/(Ls),v(D)= ![]() =
= ![]() =0.1mol/(Ls),所以v(A)=3v(D),故B正确;
=0.1mol/(Ls),所以v(A)=3v(D),故B正确;
C、反应进行到6s时,△n(B)=1mol﹣0.4mol=0.6mol,v(B)= ![]() =
= ![]() =0.05mol/(Ls),故C正确;
=0.05mol/(Ls),故C正确;
D、根据图象可知,到6s时各物质的物质的量不再改变了,达到平衡状态,所以各物质的浓度不再变化,但是由于各物质的化学计量数不相同,则各物质的反应速率不相等,故D错误;
故选BC.
A、根据图象中的有关数据判断四种物质的变化,再根据计量数之比等于物质的量的变化量之比;
B、根据图象形成1s时A、D的物质的量变化,然后根据v= ![]() 进行计算即可;
进行计算即可;
C、6s时B的浓度为0.6mol,B的物质的量变化为0.6mol,容器容积为2L,然后根据v= ![]() 进行计算B的平均反应速率;
进行计算B的平均反应速率;
D、根据图象判断反应平衡状态,化学反应速率与化学计量数成正比,计量数不同,反应速率则不相同.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。

【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3
B. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
C. 若将CO2通入0.lmol/LNa2C03溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
D. 向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO)>c(0H-)