题目内容
7.将2.3g钠放入97.7g水中,下列说法正确的是( )| A. | 产生的气体含有0.1mol的电子 | B. | 电子转移的数目为2NA | ||
| C. | 所得溶液的质量分数是等于4% | D. | 产生气体的体积为1.12L |
分析 n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,钠和水发生反应:2Na+2H2O=2NaOH+H2↑,由方程式可知生成氢气为0.1mol×$\frac{1}{2}$=0.05mol,生成NaOH为0.1mol.
A.氢气分子含有2个电子;
B.根据Na元素化合价变化计算转移电子;
C.NaOH质量为4g,溶液质量=Na的质量+水的质量-氢气总质量,溶液质量小于100g,则氢氧化钠质量分数大于4%;
D.温度、压强影响气体摩尔体积.
解答 解:n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,钠和水发生反应:2Na+2H2O=2NaOH+H2↑,由方程式可知生成氢气为0.1mol×$\frac{1}{2}$=0.05mol,生成NaOH为0.1mol.
A.每个氢气分子含有2个电子,则生成氢气中含有电子物质的量=0.05mol×2=0.1mol,故A正确;
B.每个钠原子失去一个电子,则转移电子数为0.1NA,故B错误,
C.m(NaOH)=0.1mol×40g/mol=4g,溶液质量=97.7g+2.3g-0.05mol×2g/mol=99.9g,溶液质量小于100g,则氢氧化钠质量分数大于4%,故C错误;
D.温度、压强影响气体摩尔体积,气体摩尔体积未知,不能计算氢气体积,故D错误,
故选:A.
点评 本题考查化学方程式的有关计算,D选项为易错点,注意气体摩尔体积适用范围及适用条件,题目难度不大.

练习册系列答案
相关题目
18.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-=2As+3SnCl62-+6M.关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1mol As,反应中转移电子的物质的量为3mol
④M为OH-⑤SnCl62-是氧化产物.
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1mol As,反应中转移电子的物质的量为3mol
④M为OH-⑤SnCl62-是氧化产物.
| A. | ①②④⑤ | B. | ①③⑤ | C. | ①②③④ | D. | 只有①③ |
15. 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,O2-在熔融盐中从右往左迁移 | |
| B. | 阳极电极反应式为2O2--4e-=O2↑ | |
| C. | 阳极每产生4.48L的O2,理论上能生成0.2mol钛 | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
12.向阳中学高二某小组同学设计并进行了一系列有关Fe2+与Fe3+的相关实验.
请回答下列问题:
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (I)取氧化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (II)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 |
| 实验二 | (I)取实验一得到的溶液,加入KSCN溶液. (II)再加入少量H2O2溶液. | 无明显实验现象 溶液变红,有少量气泡 |
| 实验三 | (I)取10mL0.1mol/LKI溶液,滴加6滴0.1mol/L FeCl3溶液.(II)取少量上述黄色液体,滴加KSCN溶液. (III)另取上述黄色液体,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (I)向实验三步骤I中所得的黄色溶液中加入2mLCCl4,充分振荡后,分离得到水层:重复操作三次. (II)向实验四步骤I中所得水层中加KSCN溶液. | 上层溶液无色 下层溶液为黄色 无明显实验现象 |
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
19.下列关于物质性质的说法不合理的是( )
| A. | SO2气体通入紫色石蕊试液中,溶液先变红后褪色 | |
| B. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| C. | 金属Mg与稀硫酸和CO2均能反应,其反应类型相同 | |
| D. | 氢氧化铝、碳酸铵、碳酸氢钠都既能与盐酸反应,又能与氢氧化钠溶液反应 |
16.下列离子方程式正确的是( )
| A. | 铁跟盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| B. | 铁片和CuSO4溶液的反应 2Fe+3Cu2+═3Cu+2Fe3+ | |
| C. | 钠与跟水反应 Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应Fe3++3OH-═Fe(OH)3↓ |
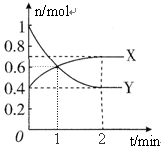 NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题
NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题