题目内容
17.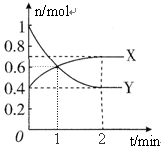 NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题
NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题(1)曲线Y(填“X”或“Y”)表示NO2的物质的量随时间变化关系曲线.
(2)若上述反应在甲、乙两个容器中进行,分别测得甲中v(NO2)=0.3mol•L-1•min-1,乙中v(N2O4)=0.2mol•L-1•min-1,则乙中反应更快.
(3)在0到1min中内用X表示该反应的速率是0.1mol/(L.min),该反应最大限度时,Y的转化率60%,计算该反应的平衡常数是8.75.
分析 (1)根据图知,1min时△n(X)=(0.7-0.4)mol=0.3mol、△n(Y)=(1.0-0.4)mol=0.6mol,X、Y的计量数之比=0.3mol:0.6mol=1:2;
(2)同一化学反应中,用不同物质表示反应速率之比等于化学计量数之比,把不同物质转化为同一种物质,数值大的反应速率快,注意单位必须相同;
(3)根据v=$\frac{△c}{△t}$计算v(X);该反应达限度时,消耗的Y为0.6mol,转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;计算平衡时各组分浓度,再根据K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$计算平衡常数.
解答 解:(1)根据图知,1min时△n(X)=(0.7-0.4)mol=0.3mol、△n(Y)=(1.0-0.4)mol=0.6mol,X、Y的计量数之比=0.3mol:0.6mol=1:2,所以曲线Y表示NO2的物质的量随时间变化关系曲线,
故答案为:Y;
(2)甲中v(NO2)=0.3mol•L-1•min-1,乙中v(N2O4)=0.2mol•L-1•min-1,则乙中v(NO2)=2v(N2O4)=0.4mol•L-1•min-1,所以乙的反应速率较快,
故答案为:乙;
(3)在0到1min中内用X表示该反应的速率=$\frac{\frac{0.6mol-0.4mol}{2L}}{1min}$=0.1mol/(L.min);
该反应达限度时,Y的转化率=$\frac{0.6mol}{1.0mol}×100%$=60%;
平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{\frac{0.7}{2L}}{(\frac{0.4}{2})^{2}}$=8.75,
故答案为:0.1mol/(L.min);60%;8.75.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,会进行化学反应速率快慢比较,比较时单位必须相同.

| A. | Fe、Mg、Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 | |
| B. | Fe在高温下能与水蒸气反应,Fe被氧化生成Fe3O4,H2O被还原生成H2 | |
| C. | 小苏打、氢氧化铝都可以用于中和胃酸 | |
| D. | 铝制餐具不适合长时间的蒸煮或长时间存放酸性、碱性或咸的食物 |
| A. | 熔化状态下,能导电的物质一定是电解质 | |
| B. | 溶于水能导电的物质一定是电解质 | |
| C. | 熔化状态下,不能导电的化合物一定不是电解质 | |
| D. | BaSO4是强电解质 |
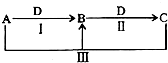 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )| A. | 若A为碳单质,则B可以用来灭火 | |
| B. | 若A为AlCl3,D为NaOH,则反应Ⅲ发生的是盐类双水解 | |
| C. | 若A为烧碱,D为CO2,则C的水溶液呈碱性 | |
| D. | 若A为氯水,D为日常生活中用途最广的金属单质,则I、Ⅱ、Ⅲ均是氧化还原反应 |
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 标准状况下,22.4LSO3含有NASO3个分子 | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 常温常压下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| A. | 产生的气体含有0.1mol的电子 | B. | 电子转移的数目为2NA | ||
| C. | 所得溶液的质量分数是等于4% | D. | 产生气体的体积为1.12L |
 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题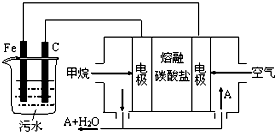 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.