题目内容
13.常温下,下列有关叙述正确的是( )| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①>②>③ | |
| D. | 10mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20mL |
分析 A、.pH=8,则c(H+)=1×10-8 mol/L,c(OH-)=1×10-6 mol/L,然后根据电荷守恒进行计算;
B、碳酸钠溶液中存在物料守恒,n(Na)=2n(C);
C、根据pH相等的三种溶液中,铵根离子水解程度越大,溶液的浓度越大分析;
D、从HA为强酸和弱酸两种情况考虑;
解答 解:A、pH=8的NaB溶液中,c(H+)=1×10-8 mol/L、c(OH-)=1×10-6 mol/L,根据电荷守恒可得:c(Na+)-c(B-)=c(OH-)-c(H+)=9.9×10-7 mol/L,故A正确;
B、在Na2CO3中,Na离子与C原子的比值为2:1,根据物料守恒可知,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,NH4HSO4电离出H+,pH相等时NH4+浓度最小;NH4Cl和(NH4)2SO4水解程度相同,则铵根离子浓度相等,则正确顺序为:①=②>③,故C错误;
D、10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,如HA为强酸,则V(总)=20mL,如HA为弱酸,则V(总)<20mL,所以所得溶液体积V(总)≤20mL,故D错误;
故选A.
点评 题考查离子浓度大小比较,题目难度中等,试题涉及pH的简单计算、离子浓度大小比较以及酸碱混合的PH的计算的等问题,本题易错点为D项,注意考虑问题的角度.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
3. 制备二氧化锰的装置如图,阳极以硫酸锰和硫酸混合液为电解液,阴极以稀硫酸为电解液,电解装置中箭头表示溶液中阳离子移动的方向.下列说法不正确的是( )
制备二氧化锰的装置如图,阳极以硫酸锰和硫酸混合液为电解液,阴极以稀硫酸为电解液,电解装置中箭头表示溶液中阳离子移动的方向.下列说法不正确的是( )
 制备二氧化锰的装置如图,阳极以硫酸锰和硫酸混合液为电解液,阴极以稀硫酸为电解液,电解装置中箭头表示溶液中阳离子移动的方向.下列说法不正确的是( )
制备二氧化锰的装置如图,阳极以硫酸锰和硫酸混合液为电解液,阴极以稀硫酸为电解液,电解装置中箭头表示溶液中阳离子移动的方向.下列说法不正确的是( )| A. | N是电源的正极 | |
| B. | 右侧气孔逸出的气体可能为副产物O2 | |
| C. | 石墨电极反应为Mn2+-2e-+2H2O=MnO2+4H+ | |
| D. | 电解过程中阳离子交换膜左侧硫酸浓度基本不变,右侧减小. |
1.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 含NA个Na+的Na2OH溶解于1L水中,Na+浓度为1mol•L-1 | |
| B. | 常温常压下,11.2LH2 中含有分分子数大于0.5NA | |
| C. | 常温常压下,30.8gCCl4中含有的原子数目为NA | |
| D. | 2L0.5mol•L-1H2O2溶液中含有的氧原子数为2NA |
8.25℃时,在等体积的①0.5mol/L的H2SO4溶液中,②0.05mol/LBa(OH)2溶液中,③1mol/LNaCl溶液中,④纯水中发生电离的水的物质的量之比是( )
| A. | 1:10:107:107 | B. | 107:107:1:1 | C. | 107:106:2:2 | D. | 107:106:2×107:2 |
18.KHCO3和K2CO3分别与NaHCO3和Na2CO3性质类似,下列比较中正确的是( )
| A. | 常温下在水中溶解性比KHCO3>K2CO3 | |
| B. | 热稳定性K2CO3<KHCO3 | |
| C. | 和酸反应放出CO2的快慢KHCO3>K2CO3 | |
| D. | 等量的盐酸分别与足量KHCO3和K2CO3反应,产生CO2一样多 |
3.若以ω1和ω2分别表示浓度为a mol/L和b mol/L硫酸溶液的质量分数,且知2a=b,则 下列推断中,正确的是( )
| A. | 2ω1=ω2 | B. | 2ω2=ω1 | C. | ω2>2ω1 | D. | ω1<ω2<2ω1 |
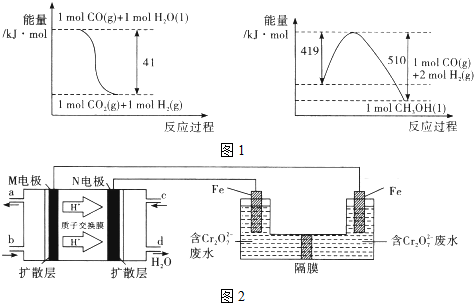
 高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热
高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热