题目内容
【题目】I.SO2是硫酸工业尾气的主要成分。实验室中,拟用下图所示流程,测定标准状况下,体积为VL的硫酸工业尾气中SO2的含量:
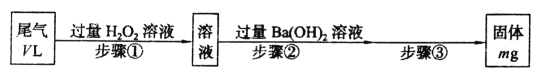
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为______________________。
(2)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数__________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为____________(填序号)。
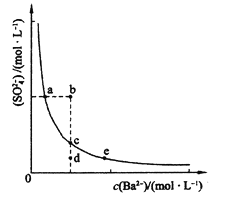
①d→c→e ②b→c→d
③a→c→e ④d→c→a
(3)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
II.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
①正确的操作步骤的顺序是(用编号字母填写):________________。
②取碱液过程中眼睛应注视_______________________。
③滴定操作中,锥形瓶残留少量蒸馏水,则测得的结果__________(填“偏大”、“偏小”或“不变”,下同);达到滴定终点时,尖嘴处尚有一滴液滴未滴下,则测得的结果____________。
【答案】I.(1)H2O2+SO2===2H++SO42-
(2)不变 ③
(3)(22.4m/233V)×100%
II. ①CADBE ②碱式滴定管刻度 ③不变 偏大
【解析】![]()
试题分析:I.(1)步骤①中加入H2O2溶液,过氧化氢具有氧化性,二氧化硫具有还原性被氧化为硫酸,发生反应的离子方程式为H2O2+SO2=2H+++SO42-;
(2)沉淀溶解平衡中硫酸根离子浓度和钡离子浓度乘积为常数,随着加入的钡离子浓度增大,硫酸根离子浓度减小;始终是饱和溶液中的沉淀溶解平衡,应在曲线上变化;bd点不是该温度下的饱和溶液;
故答案为:不变,③;
(3)mg是硫酸钡的质量,硫酸钡的物质的量为![]() =
=![]() mol,根据硫元素守恒可知二氧化硫的体积为
mol,根据硫元素守恒可知二氧化硫的体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L,故尾气中二氧化硫的体积分数=
L,故尾气中二氧化硫的体积分数=![]() =
=![]() ×100%;故答案为:
×100%;故答案为:![]() ×100%。
×100%。
II.①实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,故答案为CADBE。
②取碱液过程中眼睛应注视碱式滴定管刻度,避免多加。
③锥形瓶残留少量蒸馏水,对测定结果无影响;达到滴定终点时,尖嘴处尚有一滴液滴未滴下,则测得的结果偏大。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其一种同位素,可被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25,中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
化合物 | X3Y4 | R2T2 |
晶体类型 | ||
熔点/℃ | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。


