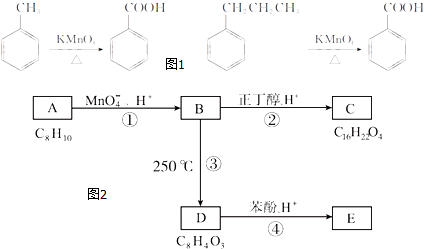
题目内容
【题目】A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.
请回答:
①上述元素中,某些元素与氢元素形成的含有十个电子的阳离子中含有配位键,请写出其离子、(填化学式).
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的电负性由大到小的顺序为(用相关元素符号表示) . F、G、H三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) .
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华.据此推测该化合物的化学键类型为 . 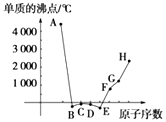
【答案】NH4+;H3O+;F>O>N;Mg>Al>Na;极性共价键
【解析】解:①上述元素中,只有N、O与氢元素形成的含有十个电子的阳离子中NH4+、H3O+中含有配位键,所以答案是:NH4+;H3O+;②同一周期元素,元素电负性随着原子序数增大而增大,所以B、C、D三种元素的电负性由大到小的顺序为F>O>N;元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以F、G、H三种元素的第一电离能由大到小的顺序为Mg>Al>Na,
所以答案是:F>O>N;Mg>Al>Na;
③H为Al元素,H的电负性为1.5,而氯元素的电负性为3.0,二者电负性差为1.5<1.7,二者形成的化合物极易水解,且易升华,则AlCl3为共价化合物,氯化铝中Al和Cl原子之间只存在极性共价键,
所以答案是:极性共价键.

练习册系列答案
相关题目