题目内容
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
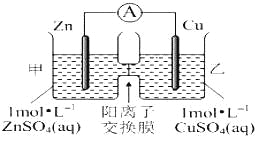
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
【答案】C
【解析】试题分析:A、由图像可知该原电池反应原理为Zn+Cu2+= Zn2++Cu,故Zn电极为负极失电子发生氧化反应,Cu电极为正极得电子发生还原反应,A错误;B、该装置中为阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,B正确;C、电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池,乙池中Cu2++2e—= Cu,故乙池中为Cu2+~Zn2+,摩尔质量M(Zn2+)>M(Cu2+),故乙池溶液的总质量增加,C错误;D、该装置中为阳离子交换膜只允许阳离子和水分子通过,电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池保持溶液中电荷平衡,阴离子并不通过交换膜,D错误;答案选B。

【题目】在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
【题目】Ⅰ、有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
相关信息 | |
X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
Y | 含Y元素的物质焰色反应为黄色 |
Z | 同周期元素中原子半径最小 |
R | R元素原子的最外层电子数是K层电子数的3倍 |
(1)Z元素在周期表的位置是 , Y、Z、R简单离子的半径从大到小的顺序是(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2 , 其溶液显黄色.则Y2R2的电子式为 , 写出乙溶液在空气中变质过程的化学方程式 . Ⅱ、元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2 . 写出其爆炸的化学方程式;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76gL﹣1 , 则物质丁的化学式为;
(6)戊在高温条件下能还原Fe2O3 , 生成两种单质,写出该反应的化学方程式 , 有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法) .