��Ŀ����
����Ŀ��������(Ti)����Ӳ�ȴ��۵�ߡ�����ʱ����ʴ�����ʱ��㷺���ڸ��¿Ƽ����Ϻͺ��������С������ᷨ�������ѵ�ԭ����������[��Ҫ�ɷ�������������FeTiO3��������Fe(��)������]��ͬʱ��ø���Ʒ�Ĺ�ҵ�����������£�
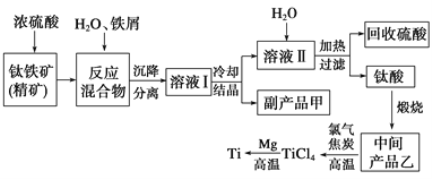
��1��Ũ���ᴦ��������ʱ����֮һ��TiOSO4����Ӧ��������ų���д���÷�Ӧ�Ļ�ѧ����ʽ___��
��2���������������м�����м��Ŀ����_______________����ѭ�����õ�������_________�����鸱��Ʒ���Ƿ���ʵ�ʵ�鷽����_________________________________��
��3����Һ���к���Fe2+��TiO2+������Mg2+�������ӡ������£����Ӧ���������Ksp���±���ʾ��
�������� | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0��10-16 | 1.0��10-29 | 1.8��10-11 |
�ٳ����£���������Һ��Mg2+�����ʵ���Ũ��Ϊ0.0018mol/L����pH����_________ʱ��Mg(OH)2��ʼ������
����������Fe2+��TiO2+��Mg2+����Һ��ˮϡ�ͣ���������������ɫ�������ó�����_______________________________________��
��4���м��Ʒ����һ��������侭��������������̿��Ӧ��������TiCl4�⣬��������һ�ֿ�ȼ�����壬��д���÷�Ӧ�Ļ�ѧ����ʽ___________��
��5��Mg��ԭTiCl4�����б�����1070K���¶��½��У�����Ϊ��ԭ���Ƶķ�Ӧ������__________________________________����Ӧ��IJ�����Ҫ����______________�ܽ����ܴﵽ�ᴿ�����ѵ�Ŀ�ġ�
���𰸡� FeTiO3��2H2SO4(Ũ)=TiOSO4��FeSO4��2H2O ��ԭFe3+ ���� ȡ����������ˮ���μ�����KSCN��Һ������Һ������Ѫ��ɫ����ײ����� 10 TiO(OH)2 TiO2+2C+2Cl2==TiCl4+2CO �������������ڶ��������Χ�У� ϡ���ᣨ��ϡ���ᣩ
����������������Ҫ�ɷ��ǣ�FeTiO3������������Mn��Zn��Cr��Cu���ؽ���Ԫ�ؼ���ʯ�����ʣ��м���Ũ���ᣬFeTiO3������Ӧ��FeTiO3��2H2SO4(Ũ)=TiOSO4��FeSO4��2H2O ���������Ũ���ᷴӦ�IJ���֮һ��TiOSO4��������м���ɷ�ֹFe2����������Һ���к���FeSO4��TiOSO4����Һ����Ҫ����TiOSO4������ˮ�����ȿ�ˮ������H2TiO3�������տ�����TiO2����������̼��Ӧ������TiCl4��������������þ��Ӧ������Ti��
��1��Ũ���ᴦ��������ʱ����֮һ��TiOSO4����Ӧ��������ų����÷�Ӧ�Ļ�ѧ����ʽ��FeTiO3��2H2SO4(Ũ)=TiOSO4��FeSO4��2H2O����2��������Fe3����Ӧ����Fe2����������м���ɷ�ֹFe2�����������������������Ӧ������Ʒ����FeSO4��7H2O����ѭ�����õ����������ᣬ���鸱��Ʒ���Ƿ���ʵ�ʵ�鷽����ȡ����Ʒ����ˮ������KSCN��Һ��Ѫ��ɫ֤������Ʒ�ױ��ʣ�����Һ������Ѫ��ɫ����ײ���������3����Ksp[Mg��OH��2]=c��Mg2������c2��OH����=1.8��10-11����c��OH����=![]() ����c��H����=
����c��H����=![]() =10-10���ʴ�ʱpH=10������֪TiO2������ˮ���������ᣨTiO(OH)2�������������ӣ������ӷ���ʽΪ��TiO2��+2H2O�TTiO(OH)2��+2H������4���м������ΪTiO2��TiO2�뽹̿�������ڸ����·�����Ӧ�������Ȼ��Ѻ�һ����̼����Ӧ�ķ���ʽΪ��TiO2+2C+2Cl2==TiCl4+2CO����5��Ϊ��ֹ̼��������Ӧ��Ӧ�ɾ��������ȣ���Ӧ��IJ�����Ҫ����ϡ���ᣨ��ϡ���ᣩþ�ܽ����ܴﵽ�ᴿ�����ѵ�Ŀ�ġ�
=10-10���ʴ�ʱpH=10������֪TiO2������ˮ���������ᣨTiO(OH)2�������������ӣ������ӷ���ʽΪ��TiO2��+2H2O�TTiO(OH)2��+2H������4���м������ΪTiO2��TiO2�뽹̿�������ڸ����·�����Ӧ�������Ȼ��Ѻ�һ����̼����Ӧ�ķ���ʽΪ��TiO2+2C+2Cl2==TiCl4+2CO����5��Ϊ��ֹ̼��������Ӧ��Ӧ�ɾ��������ȣ���Ӧ��IJ�����Ҫ����ϡ���ᣨ��ϡ���ᣩþ�ܽ����ܴﵽ�ᴿ�����ѵ�Ŀ�ġ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�