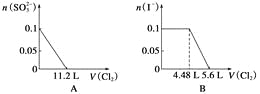
题目内容
【题目】氮化铝(AlN)具有耐高温.抗冲击.导热性好等优良性质,被广泛应用于电子工业.陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C ![]() 2AlN+3CO下列叙述正确的是( )
2AlN+3CO下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.氮化铝是铝合金中的一种
C.上述反应中每生成2molAlN,N失去6mol电子
D.氮化铝中氮元素的化合价为﹣3
【答案】D
【解析】解:A、在氮化铝的合成反应中,N2是氧化剂,Al2O3既不是氧化剂,也不是还原剂,故A错误;
B、氮化铝是化合物,而铝合金中的铝是单质,故B错误;
C、上述反应中N元素化合价由0价降低到﹣3价,每生成2mol AlN,N2得到6mol电子,故C错误;
D、由化合价代数和为0可知,氮化铝中铝元素化合价为+3价,氮元素的化合价为﹣3,故D正确;
故选D.

 阅读快车系列答案
阅读快车系列答案【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质],同时获得副产品甲的工业生产流程如下:
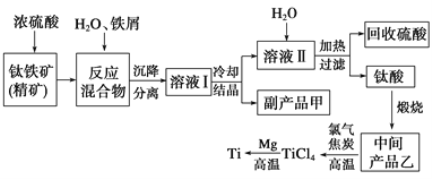
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式___。
(2)上述生产流程中加入铁屑的目的是_______________,可循环利用的物质是_________,检验副产品甲是否变质的实验方法是_________________________________。
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于_________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该沉淀是_______________________________________。
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式___________。
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是__________________________________,反应后的产物需要加入______________溶解后才能达到提纯金属钛的目的。