题目内容
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O7 2-(橙色)+ H2O![]() 2H++ 2CrO42- (黄色)。
2H++ 2CrO42- (黄色)。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72- + 8H++ 3SO32-=2Cr3+(绿色) + 3SO42- + 4H2O
下列分析正确的是
A.CrO42-和S2-在酸性溶液中可大量共存
B.实验②说明氧化性:Cr2O72->SO42-
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
【答案】B
【解析】
试题A.CrO42-在酸性溶液中转化为Cr2O72-,氧化S2-,在酸性溶液中不能大量共存,A错误;B、根据同一化学反应,氧化剂的氧化性大于氧化产物的氧化性,Cr2O7 2-是氧化剂, 硫酸根是氧化产物,所以氧化性:Cr2O7 2->SO42-,B正确;C、K2Cr2O7溶液水解显酸性,稀释该溶液,酸性减弱,c(OH-)增大,C错误;D、实验②发生的反应属于氧化还原反应,不属于平衡移动,D错误,答案选B。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
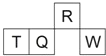
名校名卷单元同步训练测试题系列答案【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
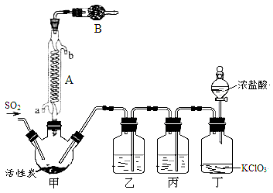
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
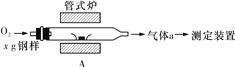
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
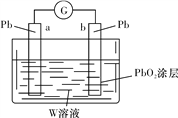
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。