题目内容
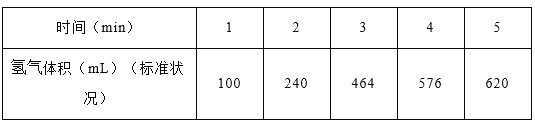
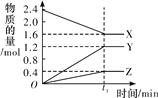
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
【答案】 2X![]() 3Y+Z(写“===”不得分) 36.8 kJ
3Y+Z(写“===”不得分) 36.8 kJ ![]() mol/(L·min) ABD
mol/(L·min) ABD
【解析】分析:(1)化学反应中,各物质的物质的量的变化值与化学计量数呈正比,以此书写化学方程式;
(2)利用转化的物质的量计算反应热,根据反应速率的含义计算;当反应中各物质的物质的量不再变化时,反应达到平衡状态,各物质的浓度不变,由此衍生的一些物理量不变。
详解:(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,作为Y、Z为生成物,当反应到达t1min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为2X![]() 3Y+Z;
3Y+Z;
(2)由于1mol氨气分解成氮气和氢气要吸收46kJ的热量,而反应中△n(X)=0.8mol,热效应为:0.8mol×46kJ/mol=36.8kJ;在此t1 min时间内生成氢气是1.2mol,浓度是0.6mol/L,则用H2表示该反应的平均速率v(H2)为![]() mol/(L·min);
mol/(L·min);
A.容器内各气体组分的质量分数不再发生改变说明正逆反应速率相等,反应达到平衡状态,A正确;
B.正反应速率与逆反应速率相等,反应达到平衡状态,B正确;
C.由于反应在体积不变的密闭容器中进行,反应过程中气体的体积不变,质量不变,则混合气体的密度不变,不能判断是否达到平衡状态,C错误;
D.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不再发生改变,反应达到平衡状态,D正确;答案选ABD。

 名校课堂系列答案
名校课堂系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为__________。
(2)⑨在元素周期表中的位置是_______________________________。
(3)用电子式表示④与⑦的原子形成化合物的过程:_________________________________。
(4)可以用来验证④⑤两种元素金属性强弱的实验是__________(填字母代号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同的这两种元素的单质分别和温度相同的热水作用,并滴入酚酞
d.比较这两种元素的氢化物的稳定性
(5)⑥⑦两种元素的简单阴离子还原性较强的是________(填离子符号);用一个置换反应证实这一结论__________________________(填化学方程式)。
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
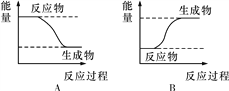
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(3)太阳能的开发和利用是21世纪的一个重要课题。
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知下列数据:
盐 | 熔点/℃ | 熔化吸热/kJ·mol-1 | 参考价格/元·kg-1 |
CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
Na2HPO4·12H2O | 36.1 | 100.1 | 1 600~2 000 |
Na2S2O3·5H2O | 48.5 | 49.7 | 1 400~1 800 |
其中最适宜作储能介质的是________(填字母代号)。
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
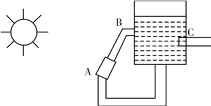
②下图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器。根据对水的密度的认识,你估计在阳光照射下水将沿________(填“顺”或“逆”)时针方向流动。