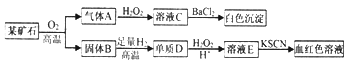
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ“ΜΕ®Έ¬Ε»œ¬Θ§‘Ύ2.5LΒΡΚψ»ίΟή±’»ίΤς÷–ΖΔ…ζ»γœ¬Ζ¥”ΠΘΚCO2(g)+H2S(g)![]() COS(g)ΘΪH2O(g)
COS(g)ΘΪH2O(g)
Β―ι | Έ¬Ε»/K | Τπ ΦΈο÷ ΒΡΝΩ/mol | ΤΫΚβΈο÷ ΒΡΝΩ/mol | ΤΫΚβ≥Θ ΐ | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74ΓΝ10-3 | |
œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A. ΗΟΖ¥”Π’ΐΖ¥”ΠΈΣΈϋ»»Ζ¥”Π
B. 607K ±Θ§Α―Έο÷ ΒΡΝΩΨυΈΣ0.1molΥΡ÷÷Ζ¥”ΠΈοΦ”»κΗΟΖ¥”ΠΤς÷–Θ§Ζ¥”ΠΫΪœρ’ΐΖ¥”ΠΖΫœρΫχ––
C. Β―ιΔρ¥οΒΫΤΫΚβ ±»ίΤς÷–COSΒΡΈο÷ ΒΡΝΩΈΣ0.02mol
D. Β―ιΔσ÷–Θ§Έό¬έ «ΩΣ ΦΜΙ «÷ΝΜ·―ßΤΫΚβΉ¥Χ§Θ§ΜλΚœΤχΧεΒΡΟήΕ» Φ÷’≤Μ±δ
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩ ‘ΧβΖ÷ΈωΘΚAΓΔCO2(g)+H2S(g)![]() COS(g)+H2O(g)Θ§‘ΎΖ¥”ΠΩΣ Φ÷–n(CO2)= 0.11molΘΜn(H2S)=0.41molΘΜ n(H2O)=0ΘΜ‘ΎΖ¥”ΠΙΐ≥Χ÷–Υ°ΗΡ±δΒΡΈο÷ ΒΡΝΩ «n(H2O)=0.01molΘ§‘ρΗυΨίΖΫ≥Χ ΫΒΡœΒ ΐΙΊœΒΩ…÷ΣΘ§n(CO2)= n(COS)= n(H2S)= n(H2O)=0.01molΓΘΥυ“‘ΤΫΚβ ±Ης÷÷Έο÷ ΒΡΈο÷ ΒΡΝΩΖ÷±π «n(CO2)=0.1molΘ§n(H2S)= 0.4molΘΜn(COS)= n(H2O)=0.01molΘ§”…”ΎΖ¥”Π«ΑΚσœΒ ΐΚΆœύΒ»Θ§Υυ“‘¥Υ ±K= [c(COS)ΓΛc(H2O)] Γ¬[c(CO2)ΓΛ c(H2S)] ="(0.01ΓΝ0.01)Γ¬(0.1ΓΝ0.4)" =0.0025ΘΦ6.74ΓΝ10-3 Θ§Έ¬Ε»…ΐΗΏΘ§K‘ω¥σΘ§ΥΒΟς…ΐΗΏΈ¬Ε»Θ§Μ·―ßΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·ΓΘΗυΨίΤΫΚβ“ΤΕ·‘≠άμΘ§…ΐΗΏΈ¬Ε»Θ§Μ·―ßΤΫΚβœρΈϋ»»Ζ¥”ΠΖΫœρ“ΤΕ·Θ§Υυ“‘ΗΟΖ¥”ΠΒΡ’ΐΖ¥”Π «Έϋ»»Ζ¥”ΠΘ§A’ΐ»ΖΘΜ BΓΔΗυΨί―ΓœνAΖ÷ΈωΩ…÷Σ607K ±ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣK=2.50ΓΝ10-3 Θ§»τΑ―Έο÷ ΒΡΝΩΨυΈΣ0.1molΥΡ÷÷Ζ¥”ΠΈοΦ”»κΗΟΖ¥”ΠΤς÷–Θ§‘ρQcΘΫ(0.1ΓΝ0.1)Γ¬(0.1ΓΝ0.1)ΘΫ1>0.0025Θ§Υυ“‘Ζ¥”ΠΡφœρΫχ––Θ§VΡφ>V’ΐΘ§B¥μΈσΘΜCΓΔΗΟΖ¥”Π «Ζ¥”Π«ΑΚσΤχΧεΧεΜΐœύΒ»ΒΡΖ¥”ΠΘ§‘ω¥σ―Ι«ΩΘ§Μ·―ßΤΫΚβ≤ΜΖΔ…ζ“ΤΕ·Θ§Υυ“‘¥οΒΫΤΫΚβ ±»ίΤς÷–COSΒΡΈο÷ ΒΡΝΩΈΣ0.02molΘ§C’ΐ»ΖΘΜDΓΔ Β―ιΔσ÷–Θ§Έό¬έ «ΩΣ ΦΜΙ «÷ΝΜ·―ßΤΫΚβΉ¥Χ§Θ§”…”ΎΖ¥”Π«ΑΚσΤχΧεΒΡΈο÷ ΒΡΝΩ≤Μ±δΘ§ΤχΧεΒΡ÷ ΝΩ≤Μ±δΘ§Υυ“‘ΜλΚœΤχΧεΒΡΟήΕ» Φ÷’≤Μ±δΘ§D’ΐ»ΖΓΘ¥πΑΗ―ΓBΓΘ
COS(g)+H2O(g)Θ§‘ΎΖ¥”ΠΩΣ Φ÷–n(CO2)= 0.11molΘΜn(H2S)=0.41molΘΜ n(H2O)=0ΘΜ‘ΎΖ¥”ΠΙΐ≥Χ÷–Υ°ΗΡ±δΒΡΈο÷ ΒΡΝΩ «n(H2O)=0.01molΘ§‘ρΗυΨίΖΫ≥Χ ΫΒΡœΒ ΐΙΊœΒΩ…÷ΣΘ§n(CO2)= n(COS)= n(H2S)= n(H2O)=0.01molΓΘΥυ“‘ΤΫΚβ ±Ης÷÷Έο÷ ΒΡΈο÷ ΒΡΝΩΖ÷±π «n(CO2)=0.1molΘ§n(H2S)= 0.4molΘΜn(COS)= n(H2O)=0.01molΘ§”…”ΎΖ¥”Π«ΑΚσœΒ ΐΚΆœύΒ»Θ§Υυ“‘¥Υ ±K= [c(COS)ΓΛc(H2O)] Γ¬[c(CO2)ΓΛ c(H2S)] ="(0.01ΓΝ0.01)Γ¬(0.1ΓΝ0.4)" =0.0025ΘΦ6.74ΓΝ10-3 Θ§Έ¬Ε»…ΐΗΏΘ§K‘ω¥σΘ§ΥΒΟς…ΐΗΏΈ¬Ε»Θ§Μ·―ßΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·ΓΘΗυΨίΤΫΚβ“ΤΕ·‘≠άμΘ§…ΐΗΏΈ¬Ε»Θ§Μ·―ßΤΫΚβœρΈϋ»»Ζ¥”ΠΖΫœρ“ΤΕ·Θ§Υυ“‘ΗΟΖ¥”ΠΒΡ’ΐΖ¥”Π «Έϋ»»Ζ¥”ΠΘ§A’ΐ»ΖΘΜ BΓΔΗυΨί―ΓœνAΖ÷ΈωΩ…÷Σ607K ±ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣK=2.50ΓΝ10-3 Θ§»τΑ―Έο÷ ΒΡΝΩΨυΈΣ0.1molΥΡ÷÷Ζ¥”ΠΈοΦ”»κΗΟΖ¥”ΠΤς÷–Θ§‘ρQcΘΫ(0.1ΓΝ0.1)Γ¬(0.1ΓΝ0.1)ΘΫ1>0.0025Θ§Υυ“‘Ζ¥”ΠΡφœρΫχ––Θ§VΡφ>V’ΐΘ§B¥μΈσΘΜCΓΔΗΟΖ¥”Π «Ζ¥”Π«ΑΚσΤχΧεΧεΜΐœύΒ»ΒΡΖ¥”ΠΘ§‘ω¥σ―Ι«ΩΘ§Μ·―ßΤΫΚβ≤ΜΖΔ…ζ“ΤΕ·Θ§Υυ“‘¥οΒΫΤΫΚβ ±»ίΤς÷–COSΒΡΈο÷ ΒΡΝΩΈΣ0.02molΘ§C’ΐ»ΖΘΜDΓΔ Β―ιΔσ÷–Θ§Έό¬έ «ΩΣ ΦΜΙ «÷ΝΜ·―ßΤΫΚβΉ¥Χ§Θ§”…”ΎΖ¥”Π«ΑΚσΤχΧεΒΡΈο÷ ΒΡΝΩ≤Μ±δΘ§ΤχΧεΒΡ÷ ΝΩ≤Μ±δΘ§Υυ“‘ΜλΚœΤχΧεΒΡΟήΕ» Φ÷’≤Μ±δΘ§D’ΐ»ΖΓΘ¥πΑΗ―ΓBΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩ“―÷Σ1molH2(g)”κ1molBr2(g)Άξ»ΪΖ¥”Π…ζ≥…2molHBr(g)Ζ≈≥ω102kJΒΡΡήΝΩΘ§ΖΫ≥Χ ΫΈΣΘΚH2(g)ΘΪBr2(g)ΘΫ2HBr(g)ΘΜ”÷÷ΣΘΚ
H2(g) | Br2(g) | HBr(g) | |
1molΖ÷Ή”÷–ΒΡΜ·―ßΦϋΕœΝ― ±–η“ΣΈϋ ’ΒΡΡήΝΩΘ®kJΘ© | 436 | a | 369 |
‘ρ±μ÷–aΈΣ
A. 200 B. 260 C. 404 D. 230
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
A. KClO3ΚΆSO3»ή”ΎΥ°ΚσΡήΒΦΒγΘ§Ι KClO3ΚΆSO3ΈΣΒγΫβ÷
B. œρCr2O72- + H2O![]() 2CrO42-+ 2H+ ΒΡΤΫΚβΧεœΒ÷–ΒΈΦ”10ΓΪ20ΒΈ6mol/LNaOH»ή“Κ―’…Ϊ”…≥»…Ϊ±δΜΤ…Ϊ
2CrO42-+ 2H+ ΒΡΤΫΚβΧεœΒ÷–ΒΈΦ”10ΓΪ20ΒΈ6mol/LNaOH»ή“Κ―’…Ϊ”…≥»…Ϊ±δΜΤ…Ϊ
C. 500ΓφΓΔ30MPaœ¬Θ§ΫΪ0.5mol N2ΚΆ1.5molH2÷Ο”ΎΟή±’ΒΡ»ίΤς÷–≥δΖ÷Ζ¥”Π…ζ≥…NH3(g)Θ§Ζ≈»»19.3kJΘ§Τδ»»Μ·―ßΖΫ≥Χ ΫΈΣ N2(g)ΘΪ3H2(g)![]() 2NH3(g) ΓςH=Θ≠38.6kJΓΛmolΘ≠1
2NH3(g) ΓςH=Θ≠38.6kJΓΛmolΘ≠1
D. “―÷ΣΘΚ
Ι≤ΦέΦϋ | CΘ≠C | C=C | CΘ≠H | HΘ≠H |
ΦϋΡή/ kJΓΛmol-1 | 348 | 610 | 413 | 436 |
‘ρΩ…“‘ΦΤΥψ≥ωΖ¥”Π ΒΡΠΛHΈΣΘ≠384 kJΓΛmol-1
ΒΡΠΛHΈΣΘ≠384 kJΓΛmol-1