题目内容
【题目】某中学化学研究性学习小组利用以下装置制取并探究氨气的性质.A中发生反应的化学方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O 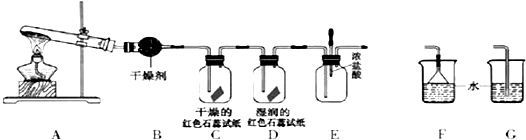
(1)A装置还可用于制取气体(只填一种).
(2)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是L.
(3)实验室收集氨气的方法是 .
(4)C、D装置中颜色会发生变化的是(填“C”或“D”)
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 .
(6)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是(填“F”或“G”).
【答案】
(1)O2
(2)4.48
(3)向下排空气法
(4)D
(5)有白烟生成
(6)F
【解析】解:(1.)该装置是加热固体制备气体的装置,还可用于制取氧气,如氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,反应的化学方程式为:2KClO3 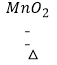 2KCl+3O2↑.所以答案是:O2;
2KCl+3O2↑.所以答案是:O2;
(2.)n(NH4Cl)═ ![]() =
= ![]() =0.2mol,根据反应方程式2NH4Cl+Ca(OH)2
=0.2mol,根据反应方程式2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O可知,n(NH3)=n(NH4Cl)=0.2mol,所以V(NH3)=nVm=0.2mol×22.4L/mol=4.48L,所以答案是:4.48;
CaCl2+2NH3↑+2H2O可知,n(NH3)=n(NH4Cl)=0.2mol,所以V(NH3)=nVm=0.2mol×22.4L/mol=4.48L,所以答案是:4.48;
(3.)氨气易溶于水,不能用排水法收集,氨气密度比空气小,所以用向下排空气法收集,所以答案是:向下排空气法;
(4.)氨气与干燥的红色石蕊试纸不变色,氨气遇水生成一水合氨,电离出的氢氧根离子能使红色石蕊试纸变蓝,所以氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化,所以答案是:D;
(5.)氨气和氯化氢反应生成固体氯化铵,将两支分别蘸取浓氨水和浓盐酸的玻璃棒靠近,浓氨水挥发出的氨气和浓盐酸挥发出的氯化氢相遇反应,可以观察到玻璃棒之间出现大量白烟;所以答案是:有白烟生成;
(6.)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置,F倒扣的漏斗具有球形部分起缓冲作用,能防止倒吸,所以答案是:F.
【考点精析】本题主要考查了氨的化学性质和氨的实验室制法的相关知识点,需要掌握与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;

 阅读快车系列答案
阅读快车系列答案