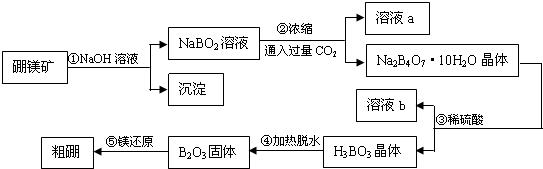
题目内容
9.下列对溶液叙述正确的是( )| A. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| B. | 对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的pH相等,则m<n | |
| C. | 在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| D. | 25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw |
分析 A.冰醋酸加水过程中,促进冰醋酸电离,氢离子浓度先增大后减小;
B.一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释过程中促进一水合氨电离;
C.容量瓶和锥形瓶不需要润洗,滴定管需要润洗;
D、水的离子积常数随温度的升高而增大.
解答 解:A.冰醋酸是分子晶体,向冰醋酸中加水,促进冰醋酸电离,氢离子浓度逐渐增大,增大到一定程度时,再向溶液中加水稀释,溶液中离子浓度反而减小,故A错误;
B.一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释过程中促进一水合氨电离,但不能完全电离,所以物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍、n倍后,若稀释后溶液的pH相等,氢氧化钠溶液中加入的水体积大于氨水,则m>n,故B错误;
C.容量瓶和锥形瓶不需要润洗,若润洗一定有误差,而滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用,不润洗相当于稀释,也存在误差,故C正确;
D、温度越高水的离子积常数越大,故D错误;
故选C.
点评 本题考查了弱电解质的电离以及电离平衡的移动、化学仪器的使用,水的离子积常数等等,题目难度不大.

练习册系列答案
相关题目
20.在探究新制饱和氯水成份的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
4.下列事实不能用勒夏特列原理解释的是( )
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 氨水应密闭保存于低温处 |
14.下列事实不能用勒夏特列原理解释的是( )
| A. | 光照新制的氯水时,溶液的 pH 逐渐减小 | |
| B. | 对 CO(g)+NO2(g)?CO2(g)+NO(g),平衡体系增大压强可使颜色变深 | |
| C. | 高压下有利于提高合成氨的产率 | |
| D. | 可用浓氨水和氢氧化钠固体快速制氨 |
1.关于下列装置说法正确的是( )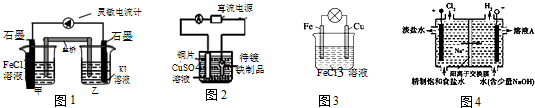

| A. | 装置①中,电流计读数为零后,在甲中溶入 FeCl2固体,乙中的石墨电极为正极 | |
| B. | 装置②中,外电路通过 1mol 电子时,铜片质量减轻 64g | |
| C. | 装置③是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
18.下列仪器中,实验时仪器的下端必须插入液面下的是( )
| A. | 分馏石油时的温度计 | B. | 制备氢气的简易装置中的长颈漏斗 | ||
| C. | 制备氯气装置中的分液漏斗 | D. | 制备乙酸乙酯时冷凝蒸气的导管 |
19.下列说法正确的是 ( )
| A. | 饮用水就是纯水,是纯净物 | |
| B. | 有机食品,就是有机合成的食品 | |
| C. | 将化工厂的烟囱建高,不能缓解大气污染 | |
| D. | 燃煤时,鼓入过量的空气可以减少酸雨的产生 |