题目内容
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
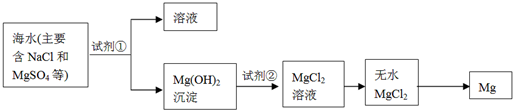
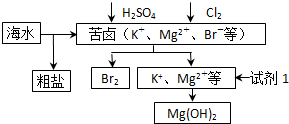
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下: 试剂①宜选用石灰乳且必须过量,过量的目的是 .
试剂①宜选用石灰乳且必须过量,过量的目的是 .
② 镁蒸气宜在 (填序号)气体冷却后得到镁锭
| A.N2 | B.CO2 | C.Ar | D.空气)(2)工业以浓缩海水为原料提取溴的部分过程如下: |
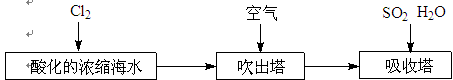
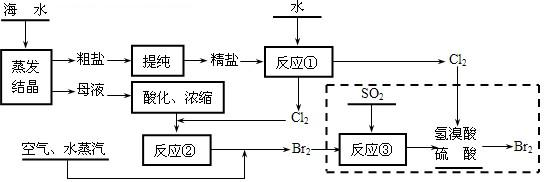
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

③A装置中通入a气体时,反应的离子方程式表示为: .
④A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是:
.
⑤反应过程中,B装置中产生的两种主要阴离子为 .
⑥C装置的作用是 。
(每空2分,其中第⑤问答对1个给1分,两个全对给2分,错 答不给分)
①使Mg2 +完全转化为Mg(OH)2沉淀 ②C ③Cl2 + 2Br-= 2 Cl-+ Br2
④将溴从蒸馏烧瓶A中吹出 ⑤SO42-、Br-
⑥吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气
解析试题分析:(1)①过量的石灰乳能使Mg2 +完全转化为Mg(OH)2沉淀。
②镁是活泼的金属,能和氧气、氮气以及CO2反应,所以应该在Ar中冷却,答案选C。
(2)③a气体应该是氯气,能把溴离子氧化生成单质溴,反应的离子方程式是Cl2 + 2Br-= 2 Cl- + Br2。
④通入热空气能将溴从蒸馏烧瓶A中吹出,提高产量。
⑤b气体是SO2,溴水能把SO2氧化生成溴化氢和硫酸,所以B装置中产生的两种主要阴离子为O42-、Br-。
⑥氢氧化钠能吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气。
考点:考查海水的综合应用、离子方程式的书写、尾气处理
点评:该题是中等难度的试题,试题注重基础和能力的双向考查,有助于培养学生的逻辑思维能力和创新思维能力。也有利于考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法错误的是( )
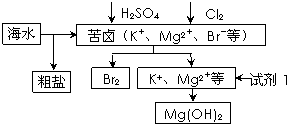

| A、可用BaCl2溶液除去粗盐中的SO42- | B、从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2 | C、试剂1可以选用石灰乳 | D、工业上,电解熔融MgO冶炼金属镁 |
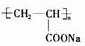
 (2012?海淀区一模)海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )
(2012?海淀区一模)海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )