题目内容
氯气与冷的氢氧化钠反应生成NaCl与NaClO,与热的氢氧化钠反应生成NaCl与NaClO3。一定温度下,氯气与氢氧化钠反应生成的NaClO与NaClO3的物质的量之比为2:3,求该反应氧化产物与还原产物的物质的量之比为( )
| A.5/16 | B.5/17 | C.5/13 | D.13/5 |
B
解析试题分析:反应中注意氯元素的化合价变化,令溶液中NaClO与NaClO3的物质的量分别为2mol、3mol,根据守恒解答.
0 +1 +5
Cl2+NaOH 2NaClO +3NaClO3 +17 NaCl + H2O
2NaClO +3NaClO3 +17 NaCl + H2O
↑1×2 ↑↓5×3 ↓1×17
根据化合价可以判断氧化产物是NaClO与NaClO3,还原产物是NaCl ,根据化合价升级配平,可以看出氧化产物的物质的量与还原产物的物质的量之比为:(2+3):17=5:17。
考点:考查氧化还原概念和守恒法。

氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于区域3的是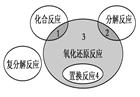
| A.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
B.2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
C.4NH3+5O2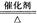 4NO+6H2O 4NO+6H2O |
| D.Fe+CuSO4=FeSO4+Cu |
有一未完成的离子方程式:□□+ XO3-+6H+═3X2+3H2O,据此判断X元素的最高化合价为
| A.+7 | B.+6 | C.+5 | D.+1 |
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液。下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 | B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明氧化性:Cr2O72->I2 | D.实验③证明H2O2既有氧化性又有还原性 |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
| A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B.在反应过程中,溶液的pH基本不变 |
| C.在反应过程中,Fe2+和Fe3+的总量保持不变 |
| D.H2O2生产过程要严格避免混入Fe2+ |
下列有关氧化还原反应的叙述中,正确的是
| A.一定有氧气参加 | B.还原剂本身被还原 |
| C.氧化反应先于还原反应发生 | D.一定有电子转移(得失或偏移) |
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用
化学方程式表示如下:2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
对此反应下列说法中正确的是( )
| A.Na2O2只作氧化剂 | B.Na2FeO4既是氧化产物又是还原产物 |
| C.O2是还原产物 | D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
纤维素还原法制取ClO2是将纤维素水解得到的最终产物C6H12O6与NaClO3在酸性条件下反应生成ClO2。下列叙述中正确的是
□C6H12O6+24NaClO3+12H2SO4=24ClO2↑+□CO2↑+18H2O+12Na2SO4
| A.方程式中产物CO2的计量数为6 |
| B.CO2是还原产物,ClO2是氧化产物 |
| C.氧化剂和还原剂的物质的量之比为4:1 |
| D.每生成1 mol CO2需转移24mol电子 |
在KClO3+6HCl(浓)=KCl+3Cl2+3H2O的反应中,当有10 mol电子发生转移后,被氧化的氯原子与被还原的氯原子的物质的量之比是
| A.1∶5 | B.5∶1 | C.6∶1 | D.1∶6 |