题目内容
16. 如图是铁钉在某溶液中被腐蚀的实验(开始时试管中液面和试管外液面等高).
如图是铁钉在某溶液中被腐蚀的实验(开始时试管中液面和试管外液面等高).(1)甲、乙两图溶液中呈酸性的是乙(填“甲”或“乙”).
(2)甲图电极反应式是:正极O2+2H2O+4e-═4OH-,负极Fe-2e-═Fe2+.
(3)乙图中发生反应的离子方程式是Fe+2H+═Fe2++H2↑.
分析 从两图中液面的高度可以看出,甲图试管内液面上升,说明气体体积减小,氧气被吸收,发生吸氧腐蚀,乙图试管内液面下降,说明气体体积增大,有氢气生成,发生析氢腐蚀,以此解答.
解答 解:从两图中液面的高度可以看出,甲图试管内液面上升,说明气体体积减小,氧气被吸收,发生吸氧腐蚀,乙图试管内液面下降,说明气体体积增大,有氢气生成,发生析氢腐蚀,
(1)由以上分析可知乙发生析氢腐蚀,溶液呈酸性,故答案为:乙;
(2)甲发生吸氧腐蚀,正极发生还原反应,电极方程式为O2+2H2O+4e-═4OH-,负极发生氧化反应,电极方程式为Fe-2e-═Fe2+,
故答案为:O2+2H2O+4e-═4OH-;Fe-2e-═Fe2+;
(3)乙发生析氢腐蚀,铁被氧化,同时生成氢气,离子方程式为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑.
点评 本题考查了钢铁的电化学腐蚀,为高频考点,侧重于学生的分析能力的考查,注意酸性条件下,钢铁发生析氢腐蚀,弱酸性或中性条件下,钢铁发生吸氧腐蚀,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列化学用语正确的是( )
| A. | H2O2的电子式 | B. | CO2的比例模型 | ||
| C. | S2-的结构示意图  | D. | 次氯酸的结构式:H-O-Cl |
4.以下化学用语正确的是( )
| A. | 乙烯的结构简式CH2CH2 | B. | 羟基的电子式[:O:H]- | ||
| C. | 乙醛的分子式C2H4O | D. | 乙醇的结构式CH3CH2OH |
8.下列关于乙醇的说法不正确的是( )
| A. | 可用淀粉的水解产物制取 | B. | 可由乙烯通过消去反应制取 | ||
| C. | 与甲醚(CH3OCH3)互为同分异构体 | D. | 通过氧化反应可制取乙醛 |
6.W、X、Y、Z、M、R为6种短周期元素.W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与R原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如图所示.
(1)Z元素位于周期表第二周期ⅣA族.
(2)R离子的结构示意图为 .
.
(3)Z、M、R三种元素的简单氢化物中,沸点最高的是H2O(填分子式).
(4)六种元素原子半径从大到小的顺序为Na>Al>C>O>F>H(用元素符号表示).
(5)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(6)Y4Z3能与M的简单氢化物反应生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4↑.
(7)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为 .
.
| Z | M | R | ||
| Y |
(2)R离子的结构示意图为
 .
.(3)Z、M、R三种元素的简单氢化物中,沸点最高的是H2O(填分子式).
(4)六种元素原子半径从大到小的顺序为Na>Al>C>O>F>H(用元素符号表示).
(5)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(6)Y4Z3能与M的简单氢化物反应生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4↑.
(7)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为
 .
. 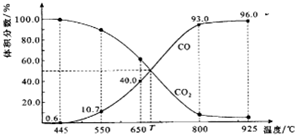 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示: ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧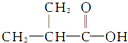 ⑨CH3CHBrCH3 ⑩
⑨CH3CHBrCH3 ⑩ ⑪
⑪
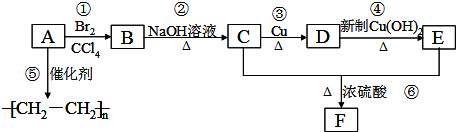
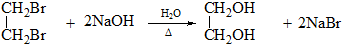
 .
.