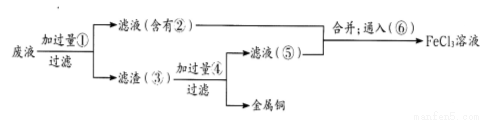
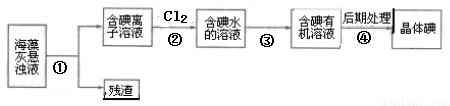
题目内容
把19.2 g Cu放入足量的稀硝酸中,微热至Cu完全反应。
求:(1)生成的NO在标准状况下的体积。
(2)被还原的硝酸的质量。
(1)4.48L;(2)12.6g。
【解析】
试题分析:根据公式n=m/M计算,19.2g 的Cu的物质的量为0.3mol,
(1)设产生的NO在标准状况下的体积为V,则
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 44.8L
0.3mol V
V=4.48L,
答:产生的NO在标准状况下的体积为4.48L。
(2)由方程式可以看出,硝酸没有全部被还原,当有3mol铜反应时,有2molHNO3被还原,则0.3mol硝酸参加反应,被还原的硝酸的物质的量为0.2mol,质量为:0.2mol×63g/mol=12.6g。
考点:考查根据化学方程式的计算及氧化还原反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸 分子式:HCl 相对分子质量:36.5,密度:1.19 g·cm-3 HCl的质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为__ ____mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取___ _____mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面 ( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ( )
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。(精确到小数点后一位)
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出