题目内容
【题目】有机物A有如图所示的转化关系 
已知①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%
②CH3CH2COOH+Cl2 ![]()
![]() +HCl
+HCl
③G分子结构中含有3个六元环
根据以上信息,回答下列问题:
(1)有机物F中官能团的名称是 .
(2)A的名称是 .
(3)条件Ⅲ 为 , F→G的反应类型为 , G的结构简式为 .
(4)写出一种检验M中官能团的化学方程式
(5)R是N的同系物,相对分子质量比N大14,R有多种同分异构体,则同时符合下列条件的同分异构体有种,其中核磁共振氢谱为4组峰,且峰面积之比为3:2:2:1的有机物结构简式为 . a.含有笨环 b.能发生银镜反应 c.遇FeCl3溶液不显紫色 d.不含醚键
(6)写出下列转化的化学方程式:F→E .
【答案】
(1)羟基、羧基
(2)苯丙酸苯甲酯
(3)浓硫酸、加热;酯化反应;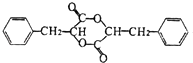
(4)![]() +2Cu(OH)2
+2Cu(OH)2 ![]() ?
?  +Cu2O↓+2H2O
+Cu2O↓+2H2O
(5)8;![]()
(6)![]()
【解析】解:(1)F为 ![]() ,F中官能团名称是羟基、羧基,
,F中官能团名称是羟基、羧基,
所以答案是:羟基、羧基;(2)A的结构简式为 ![]() ,名称为苯丙酸苯甲酯,所以答案是:苯丙酸苯甲酯;(3)通过以上分析知,条件Ⅲ为浓硫酸、加热;F→G的反应类型为酯化反应,G的结构简式为
,名称为苯丙酸苯甲酯,所以答案是:苯丙酸苯甲酯;(3)通过以上分析知,条件Ⅲ为浓硫酸、加热;F→G的反应类型为酯化反应,G的结构简式为  ,
,
所以答案是:浓硫酸、加热;酯化反应;  ;(4)M为
;(4)M为 ![]() ,检验醛基可以与新制的氢氧化铜反应,化学方程式为:
,检验醛基可以与新制的氢氧化铜反应,化学方程式为: ![]() +2Cu(OH)2
+2Cu(OH)2 ![]()
 +Cu2O↓+2H2O,所以答案是:
+Cu2O↓+2H2O,所以答案是: ![]() +2Cu(OH)2
+2Cu(OH)2 ![]()
 +Cu2O↓+2H2O;(5)N为
+Cu2O↓+2H2O;(5)N为  ,R是N的同系物,相对分子质量比N大14,即R中含有羧基,且分子中碳原子数比N多一个,根据条件:a.含有苯环,b.能发生银镜反应,说明有醛,c.遇FeCl3溶液不显紫色,说明不含有酚羟基,d.不含醚键,则符合条件的R的结构为苯环上连有HCOO﹣、﹣CH3 , 或连有﹣CHO、﹣CH2OH,每种都有邻间对三种,或连有﹣CH(OH)CHO、HCOOCH2﹣,所以共有8种,其中核磁共振氢谱为4组峰,且峰面积之比为3:2:2:1的有机物结构简式为
,R是N的同系物,相对分子质量比N大14,即R中含有羧基,且分子中碳原子数比N多一个,根据条件:a.含有苯环,b.能发生银镜反应,说明有醛,c.遇FeCl3溶液不显紫色,说明不含有酚羟基,d.不含醚键,则符合条件的R的结构为苯环上连有HCOO﹣、﹣CH3 , 或连有﹣CHO、﹣CH2OH,每种都有邻间对三种,或连有﹣CH(OH)CHO、HCOOCH2﹣,所以共有8种,其中核磁共振氢谱为4组峰,且峰面积之比为3:2:2:1的有机物结构简式为 ![]() ,
,
所以答案是:8; ![]() ;(6)F发生消去反应生成E,反应方程式为
;(6)F发生消去反应生成E,反应方程式为 ![]() ,所以答案是:
,所以答案是: ![]() .
.

【题目】钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
(1)Ⅰ LiCoO2中钴元素的化合价为 .
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为可用盐酸代替H2SO4和H2O2的混合液,但缺点是 .
(3)Ⅱ 利用一种含钴矿石[主要成分为Co2O3 , 含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O42H2O工艺流程如下: 
已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
浸出过程中加入NaClO3的目的是 .
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因 .
(5)滤液Ⅱ中加入萃取剂的作用是 .
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10﹣11 , Ksp(CaF2)=1.05×10﹣10 . 当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= .
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如图: 
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为 .
(2)“溶解”时放出的气体为(填化学式).
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+ , 其离子方程式为 .
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr2+ | 4.5 | 5.6 |
“调pH1“时,溶液pH范围为;过滤2所得滤渣的成分为 .
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式 .
(6)若加热不充分,则制得的NiOOH会混有Ni(OH)2 , 其组成可表示为xNiOOHyNi(OH)2 . 现称取8.29gxNiOOHyNi(OH)2样品溶于稀硫酸,搅拌至溶液清亮,定容至200mL,从中移取20.00mL,用0.010molL﹣1的,KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4标准溶液20.00mL.已知5Ni2++MnO4﹣+8H+═5Ni2++Mn2++4H2O,则x= , y= .
