��Ŀ����
����Ŀ���й���ѧԺ�ٷ�����2017��3�·���������ר�⡷�����������ϸ������ij����ַ�������ͼ��ʾ��
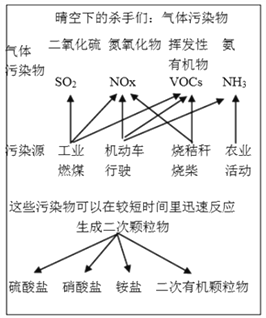
��1��������ͼ��Ϣ���Կ�������������������Ⱦ�������ɻ�������ʻ��ɵ�_______________��
a��SO2 b��NOx c��VOCs d�� NH3
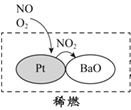
��2��������������ʻ����ȾԴ֮һ����������������ϡȼ����ϵͳ��Ҫ����ԭ����ͼ��ʾ��д��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽ_______________��
��3����ѧ�Ҿ����о������й��������ԣ�����Ҫԭ������ͼ��ʾ��
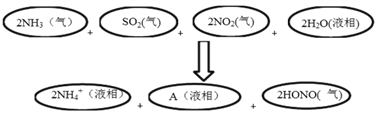
���ж�A�Ļ�ѧʽ��˵���ж����ɣ�_____________________________________________��
��4��úȼ���ŷŵ���������SO2��NOx������NaClO2��Һ��Ϊ���ռ���ͬʱ��������������������������SO2��NOx������ͨ��ʢ��NaClO2��Һ�ķ�Ӧ���У���Ӧһ��ʱ������Һ������Ũ�ȵ��й��������£��������Ӻ��Բ��ƣ���
���� | Na+ | SO42 | NO3 | H+ | Cl |
Ũ��/��mol��L1�� | 5.5��103 | 8.5��104 | y | 2.0��104 | 3.4��103 |
��SO2��NaClO2��Һ��Ӧ�����ӷ���ʽ��________________________________________��
�ڱ���y ��_______________��
���𰸡� a 2NO+O2=2NO2 SO42-����Ϊ��ӦǰS+4�ۣ�N+4�ۣ���Ӧ��HONO��NԪ��+3�ۣ����ϼ۽��ͣ������Ԫ�ػ��ϼ����ߣ���SԪ�ش�+4���ߵ�+6�ۣ���SO42-��ʽ���� 2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ 6��104
����������1������ʾ��ͼ��֪SO2�����ɻ�������ʻ��ɵģ��ʴ�Ϊa��
��2��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽΪ��2NO+O2=2NO2��
��3����ӦǰSԪ��Ϊ+4�ۣ�NԪ��Ϊ+4�ۣ���Ӧ��HONO��NԪ��Ϊ+3�ۣ����ϼ۽��ͣ��л��ϼ۵Ľ��ͣ�����Ԫ�ػ��ϼ����ߣ�������SԪ�ش�+4���ߵ�+6�ۣ���A����ΪSO42-������Ҳ�ɸ��������غ��Ƴ�A�Ļ�ѧʽΪSO42-���ʴ�Ϊ��SO42-����Ϊ��ӦǰS+4�ۣ�N+4�ۣ���Ӧ��HONO��NԪ��+3�ۣ����ϼ۽��ͣ������Ԫ�ػ��ϼ����ߣ���SԪ�ش�+4���ߵ�+6�ۣ���SO42-��ʽ���ڡ�
��4���� SO2���л�ԭ�ԣ� NaClO2����ǿ�����ԣ����߷���������ԭ��Ӧ�����ӷ���ʽΪ�� 2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ �� ����Һ�Ե����ԣ��������������������ֵ�������������ĸ������ֵ��ȣ���1��5.5��103+1��2.0��104=2��8.5��104+ y��1+1��3.4��103������y= 6��104��

����Ŀ�����ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â����ֽ©�����²����մ���������������ɳ�С�����֪��Al��Al2O3��Fe��Fe2O3���۵㡢�е����������
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1 535 | 1 462 |
�е�/�� | 2 467 | 2 980 | 2 750 | �� |
I����1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ������_____���������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���________����Ӧ�����ӷ���ʽΪ_____________________��
��3��ʵ�����ܽ��������������Լ��������˵��Լ���_________������ţ���
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
��ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų�,��ʱ��Һ�е�Ԫ�صĴ�����ʽֻ��NO3-��NH4+,��Ԫ�صĴ�����ʽΪFe3+,�ڷ�Ӧ���������Һ�У���μ���6molL��1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺

��1�������⣬��д���������������ϡ�����ᷴӦ�����ӷ���ʽ��___________��
��2����CD�Σ����������ʵ������٣���˽η�����Ӧ�����ӷ���ʽΪ________________��
��3������������Ԫ�ص����ʵ���Ϊ_______mol��
��4��B���Ӧ�ij��������ʵ���Ϊ____mol��
