题目内容
【题目】某化学实验小组的同学为探究和比较SO2和Cl2的漂白性,设计了如下的实验装置。

(1)实验室常用软锰矿(主要成分是MnO2)与浓盐酸混合加热的方法制备Cl2,写出实验室制备氯气的化学方程式:________________________________________________。在此化学反应中,氧化剂与还原剂的物质的量之比为____________;若反应过程中转移电子的物质的量为6 mol,则生成氯气的物质的量为____________mol。
(2)反应开始一段时间后, B、D两个试管中的品红溶液出现的现象是: B:_______________________; D:________________________;
(3)停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别是:B:_______________________; D:________________________;
(4)实验中NaOH溶液的作用是________________________________________。若将C中NaOH溶液换成水,当通入物质的量比为1:1的SO2和Cl2,恰好反应生成两种强酸(其中一种是含氧酸,另一种是无氧酸),该反应的化学方程式是:_____________________________________________________________________。
【答案】 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1:2 3 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 吸收多余的SO2和Cl2 Cl2+SO2+2H2O===2HCl+H2SO4
MnCl2+Cl2↑+2H2O 1:2 3 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 吸收多余的SO2和Cl2 Cl2+SO2+2H2O===2HCl+H2SO4
【解析】考查实验方案设计与评价,(1)制备氯气反应方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,根据化学反应方程式,MnO2为氧化剂,HCl其中一部分作还原剂,一部分作酸性,因此氧化剂与还原剂的物质的量之比为1:2;生成1molCl2,转移电子物质的量为2mol,因此转移电子物质的量为6mol,产生氯气物质的量为6/2mol=3mol;(2)B:SO2具有漂白性,能使品红溶液褪色,D:品红溶液褪色;(3)B:SO2能使品红溶液褪色,原因是SO2与有色物质结合成不稳定物质,受热恢复到原来的颜色,因此试管B加热现象:褪色的品红又恢复成红色;D:试管D品红溶液褪色的原因是利用物质的强氧化性,把有色物质氧化,加热不能恢复到原来的颜色,因此加热试管D现象是无明显现象;(4)Cl2、SO2有毒,污染空气,因此NaOH溶液的目的是吸收多余的Cl2和SO2;氯气具有强氧化性,SO2以还原性为主,两者发生Cl2+SO2+H2O=2HCl+H2SO4。
MnCl2+Cl2↑+2H2O,根据化学反应方程式,MnO2为氧化剂,HCl其中一部分作还原剂,一部分作酸性,因此氧化剂与还原剂的物质的量之比为1:2;生成1molCl2,转移电子物质的量为2mol,因此转移电子物质的量为6mol,产生氯气物质的量为6/2mol=3mol;(2)B:SO2具有漂白性,能使品红溶液褪色,D:品红溶液褪色;(3)B:SO2能使品红溶液褪色,原因是SO2与有色物质结合成不稳定物质,受热恢复到原来的颜色,因此试管B加热现象:褪色的品红又恢复成红色;D:试管D品红溶液褪色的原因是利用物质的强氧化性,把有色物质氧化,加热不能恢复到原来的颜色,因此加热试管D现象是无明显现象;(4)Cl2、SO2有毒,污染空气,因此NaOH溶液的目的是吸收多余的Cl2和SO2;氯气具有强氧化性,SO2以还原性为主,两者发生Cl2+SO2+H2O=2HCl+H2SO4。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。
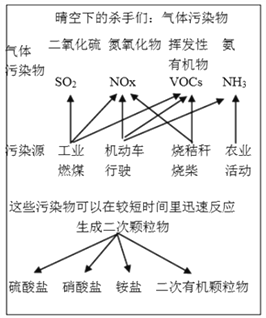
(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_______________。
a.SO2 b.NOx c.VOCs d. NH3
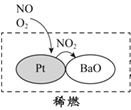
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______________。
(3)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
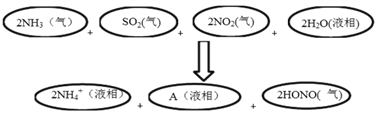
请判断A的化学式并说明判断理由:_____________________________________________。
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42 | NO3 | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.0×104 | 3.4×103 |
①SO2和NaClO2溶液反应的离子方程式是________________________________________。
②表中y =_______________。
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。

供选试剂:30%H2O2溶液、0.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向I的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。