题目内容
20.简单计算:(1)0.5mol CH4的质量是8g,含12.04×6.02×1023个氢原子,5×6.02×1023个质子.
(2)标准状况下4.48L的HCl 溶于水配成100mL的溶液,所得溶液的物质的量浓度为2.0 mol/L,将上述溶液加水稀释到200mL,取出5mL,这5mL溶液的物质的量浓度是1.0mol/L.
(3)科学家已发现一种新型氢分子H3,在相同条件下,等质量的H3和H2,原子个数之比=1:1,分子个数之比=2:3.
(4)一定条件下,21.6gA单质与1.20molCl 2完全反应,生成0.8molAClx,则x=3,A的摩尔质量为27g/mol.
(5)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42-)=0.8mol/L,则c(K+)为0.3mol/L.
分析 (1)结合m=nM及分子构成计算;
(2)结合n=$\frac{V}{Vm}$、c=$\frac{n}{V}$及溶液均一性分析;
(3)等质量的H3和H2,H原子的物质的量相同,结合n=$\frac{m}{M}$、N=nNA计算;
(4)生成0.8molAClx,由Cl原子守恒计算x,结合M=$\frac{m}{n}$计算;
(5)结合电荷守恒计算.
解答 解:(1)0.5mol CH4的质量是0.5mol×16g/mol=8g,含0.5mol×4×6.02×1023=12.04×6.02×1023个氢原子,0.5mol×10×6.02×1023=5×6.02×1023个质子,故答案为:8;12.04×6.02×1023;5×6.02×1023;
(2)n(HCl)=$\frac{4.48L}{22.4L/mol}$=0.2mol,c=$\frac{0.2mol}{0.1L}$=2.0mol/L,加水稀释到200mL,浓度为$\frac{0.2mol}{0.2L}$=1.0mol/L,取出5mL,这5mL溶液的物质的量浓度是1.0mol/L,
故答案为:2.0;1.0;
(3)等质量的H3和H2,均由H原子构成的分子,H原子的物质的量相同,原子个数之比=1:1,分子个数之比=$\frac{m}{3}$:$\frac{m}{2}$=2:3,故答案为:1:1;2:3;
(4)生成0.8molAClx,由Cl原子守恒可知0.8mol×x=1.2mol×2,解得x=3;A的摩尔质量为$\frac{21.6g}{0.8mol}$=27g/mol,故答案为:3;27g/mol;
(5)设c(K+)为x,由电荷守恒可知,x+0.1+0.4×3=0.8×2,解得x=0.3mol/L,故答案为:0.3mol/L.
点评 本题考查综合物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式及原子守恒、电荷守恒的运用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | Fe2O3常用于制造红色油漆和涂料 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 氧化铝可用来制造耐高温的实验仪器 | |
| D. | 二氧化硅可用于制造光导纤维 |
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.可能大量含有的阳离子H+、Ag+、Mg2+、Al3+、NH4+、Fe3+
可能大量含有的阴离子CO32-、AlO2-、NO3-
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
| A. | HCl→Cl2 | B. | H2S→SO2 | C. | Fe2O3→Fe | D. | CaO→Ca(OH)2 |
| A. | 恒温下压缩体积,容器中气体的平均相对分子质量减少 | |
| B. | 再加入一定量氨基甲酸铵,平衡正向移动 | |
| C. | CO2的体积分数不变则该反应达到平衡状态 | |
| D. | 25℃时氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 |
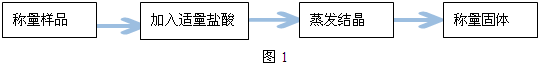
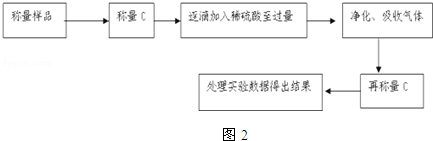
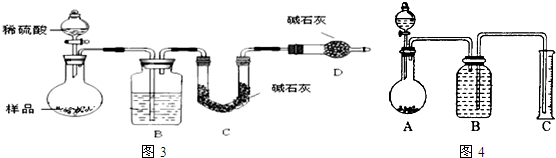
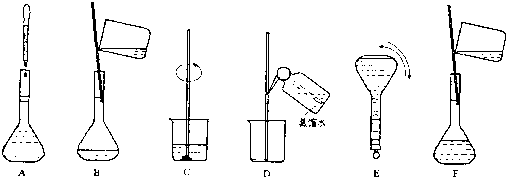
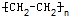 反应类型加聚反应(或聚合反应);
反应类型加聚反应(或聚合反应); 反应类型取代反应
反应类型取代反应 _反应类型加聚反应
_反应类型加聚反应