题目内容
18.将10gNaCl和NaI的混合物溶于水后,通入足量的Cl2,将溶液蒸干后灼烧得固体6.34g,求原混合物中NaCl的质量.分析 碘化钠和氯气反应方程式为2NaI+Cl2=I2+2NaCl,碘在灼烧时会升华,所以灼烧后固体为NaCl,溶液蒸干灼烧前后固体质量减少量为碘与氯元素质量之差,据此分析解答.
解答 解:碘化钠和氯气反应方程式为2NaI+Cl2=I2+2NaCl,碘在灼烧时会升华,所以灼烧后固体为NaCl,溶液蒸干灼烧前后固体质量减少量为碘与氯元素质量之差,设原混合物中NaCl的质量为xg,则NaI的质量为(10-x)g,
2NaI+Cl2=I2+2NaCl 钠盐质量差
300 183
(10-x)g (10-6.34)g
300:183=(10-x)g:(10-6.34)g
x=10-$\frac{(10-6.34)g×300}{183}$=6,
答:原混合物中氯化钠的质量为6g.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量之间关系式是解本题关键,注意差量法的应用,题目难度不大.

练习册系列答案
相关题目
8.下列事实不能用勒夏特列原理解释的是( )
| A. | 对盛在烧杯(敞口)内的氨水加热,氨水中NH${\;}_{4}^{+}$浓度减小 | |
| B. | 对石灰的悬浊液加热使温度升高,悬浊液中Ca(OH)2固体的含量增加 | |
| C. | 高压有利于合成氨的反应 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
6.下列单体中,在一定条件下能发生加聚反应生成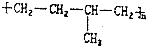 的是( )
的是( )
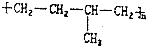 的是( )
的是( )| A. | 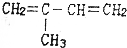 | B. | 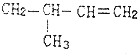 | ||
| C. | CH3CH═CH2和CH2═CH2 | D. | CH3CH═CH2 |
13.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L乙醇在电池的负极放电生成CO2时,共失去12mol 电子 | |
| B. | 1mol/L碳酸钠溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1mol | |
| C. | 25℃时,1L pH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| D. | 电解精炼铜,当电路中转移NA个电子,阳极溶解的铜<32g,阴极析出铜32g |
2.已知下列数据,则下列热化学方程式不正确的是( )
| 化学键 | H-H | Cl-Cl | H-Cl |
| 生成(拆开)1mol化学键放出(吸收)的能量 | 436kJ | 243kJ | 431kJ |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ•mol-1 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=+91.5kJ•mol-1 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183kJ•mol-1 |
9.下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa):
①C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ•mol-1
②C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658kJ•mol-1
③C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(l)△H=-1 746kJ•mol-1
④C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(g)△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热是( )
①C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ•mol-1
②C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658kJ•mol-1
③C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(l)△H=-1 746kJ•mol-1
④C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(g)△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热是( )
| A. | △H=-2 878 kJ•mol-1 | B. | △H=-2 658 kJ•mol-1 | ||
| C. | △H=-1 746 kJ•mol-1 | D. | △H=-1 526 kJ•mol-1 |
7.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )


| A. | 电源B 极的名称是负极 | |
| B. | 甲装置中电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4 | |
| C. | 设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是1:1 | |
| D. | 设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L. |