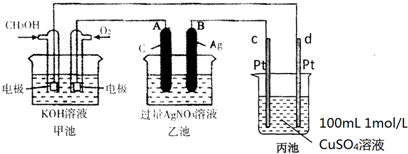
题目内容
9.将8.4g NaHCO3加入到500mL 0.8mol/L的盐酸中,使其充分反应,反应后将溶液加水稀释至500ml,计算:①生成的二氧化碳在标准状况下的体积;
②稀释后溶液中H+的物质的量浓度.(要有必要的解题过程)
分析 n(NaHCO3)=$\frac{8.4g}{84g/mol}$=0.1mol,n(HCl)=0.8mol/L×0.5L=0.4mol,反应方程式为:NaHCO3+HCl═NaCl+CO2↑+H2O,
根据方程式知,碳酸氢钠完全反应需要稀盐酸0.1mol<0.4mol,则HCl过量,
①根据NaHCO3计算,根据C原子守恒计算n(CO2),再根据V=nVm计算气体体积;
②消耗的n(HCl)═0.1mol,反应后溶液中剩余的n(HCl)═(0.4-0.1)mol═0.3mol,
即溶液中n(H+)═0.3mol,故稀释后溶液中H+的物质的量浓度为$\frac{n}{V}$.
解答 解:n(NaHCO3)=$\frac{8.4g}{84g/mol}$=0.1mol,n(HCl)=0.8mol/L×0.5L=0.4mol,反应方程式为:NaHCO3+HCl═NaCl+CO2↑+H2O,
根据方程式知,碳酸氢钠完全反应需要稀盐酸0.1mol<0.4mol,则HCl过量,
①根据NaHCO3计算,根据C原子守恒计算n(CO2)=n(NaHCO3)═0.1mol,
即生成的n(CO2)的标准状况下的体积为0.1mol×22.4L/mol═2.24L,
答:生成二氧化碳体积为2.24L;
②消耗的n(HCl)=n(CO2)=0.1mol,
反应后溶液中剩余的n(HCl)=(0.4-0.1)mol=0.3mol,
即溶液中n(H+)=0.3mol,故稀释后溶液中H+的物质的量浓度为$\frac{0.3mol}{0.5L}$=0.6mol/L,
答:稀释后溶液中H+的物质的量浓度为0.6mol/L.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,注意该题要先过量计算,为易错点.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案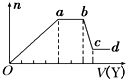 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.| 阴离子 | CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{3}^{-}$、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH${\;}_{4}^{+}$、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{-}$和NH${\;}_{4}^{+}$ | |
| B. | 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH${\;}_{4}^{+}$、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH${\;}_{4}^{+}$+OH-=NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH${\;}_{4}^{+}$物质的量之比为2:1:4 |
| A. | Mg2+、K+、NO3-、OH- | B. | Ba2+、NH4+、NO3-、OH- | ||
| C. | Ca2+、K+、SO42-、Cl- | D. | Ba2+、Na+、Cl-、NO3- |
| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:2c(HCO3-)+2c (CO32-)+2c(H2CO3)=c(Na+) | |
| C. | 常温下,稀释0.1mol/L的氨水,溶液中所有离子浓度均下降 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |
| A. | 2Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S | B. | Cl2+SO2+2H2O═H2SO4+2HCl | ||
| C. | 2H2S+SO2═3S↓+2H2O | D. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O |
| A. | 直接往该溶液中滴加稀H2S04后产生大量气泡,证明原溶液含C032- | |
| B. | 取少量溶液加入Ba(NO3)2溶液后产生白色沉淀,证明原溶液中含SO42- | |
| C. | 取少量溶液加入HCl酸化后滴加AgN03溶液产生白色沉淀,证明原溶液中含Cl-. | |
| D. | 取少量溶液加入HCl酸化后滴加BaCL2溶液产生白色沉淀,证明原溶液中含SO42- |

 .
. .
. 2CH3CHO+2H2O.
2CH3CHO+2H2O. .
.