题目内容
(8分)
(1)已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率
入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 为80%时,该反应
为80%时,该反应
(填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。
(填“正反应”或“逆反应”) 方向进行。
(2)对于可逆反应:aA(g) +bB(g) cC(g)+dD(g) △H = a kJ·mol
cC(g)+dD(g) △H = a kJ·mol -1;
-1;
若增大压强平衡向正反应方向移动,则a+b c+d(填“>”或“<”);若升高温度,平衡向正反应方向移动,则a_______0(填“>”或“<”)

(1)已知某温度下,反应2SO2+O2
 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率
入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 为80%时,该反应
为80%时,该反应(填“是”或“否”)达到化学平衡状态,若未达到,向
 (填“正反应”或“逆反应”) 方向进行。
(填“正反应”或“逆反应”) 方向进行。(2)对于可逆反应:aA(g) +bB(g)
 cC(g)+dD(g) △H = a kJ·mol
cC(g)+dD(g) △H = a kJ·mol -1;
-1;若增大压强平衡向正反应方向移动,则a+b c+d(填“>”或“<”);若升高温度,平衡向正反应方向移动,则a_______0(填“>”或“<”)
(1)否 逆反应 (2)> >
略

练习册系列答案
相关题目




 2CO(g),K1
2CO(g),K1 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下: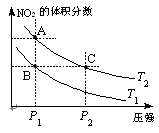
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)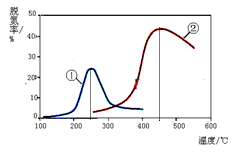
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率) 2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,  2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。
 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
 B(g)+2C(g),增大压强反应速率加快,A的转化率减小
B(g)+2C(g),增大压强反应速率加快,A的转化率减小 xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )