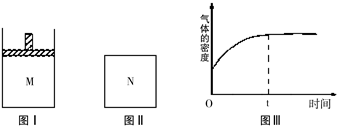
��Ŀ����
��һ�������£�xA + yB zC���ﵽƽ�⣬����д���пհף�
zC���ﵽƽ�⣬����д���пհף�
��1����A��B��C�������壬��ѹ�����淴Ӧ�����ƶ�����x��y��x֮��Ĺ�ϵ��x + y z��
��2����֪C�����壬��x + y �� z�������ѹʱƽ�ⷢ���ƶ�����ƽ����� �� �����ƶ�����A��B��״̬��������һ����_____________________��
��3����B��C�����壬������������ʱ����A��������ƽ�ⲻ�ƶ�����A��״̬Ϊ ������ ��
��4�����Ⱥ�C�İٷֺ������٣�������Ӧ�� ��Ӧ��ѡ����ȡ��������ȡ�����
��1��>����2���� �����Һ�壻��3�������Һ�壻��4������
���������������1����ѹ�����淴Ӧ�����ƶ�����Ӧ������Ļ�ѧ��������������������Ļ�ѧ��������Ӧ��x+y��z����2����A��B�������壬�ı�ѹǿƽ�ⲻ�ƶ������й����Һ�壬��һ�����淴Ӧ�����ƶ���
��3������A��������ƽ�ⲻ�ƶ���˵��A��Ũ�Ȳ��䣬��AӦΪ�����Һ�壻��4�����Ⱥ�C�İٷֺ������٣�˵��ƽ�����淴Ӧ�����ƶ���������Ӧ�Ƿ��ȷ�Ӧ��
���㣺��ѧƽ���Ӱ������

���Գ��˵����ӦP��g��+Q��g�� R��g��+S��g���ں������Ѵﵽƽ����
R��g��+S��g���ں������Ѵﵽƽ����
| A����Ӧ�����ڵ�ѹǿ����ʱ��ı� |
| B����Ӧ������P��Q��R��S����Ũ��֮��Ϊ1:1:1:1 |
| C��P���������ʺ�S������������� |
| D����Ӧ�����ڵ����������ʵ�������ʱ��仯 |
��4 L�ܱ������г���6 mol A�����5 mol B���壬��һ�������·�����Ӧ��
3A(g) + B(g)  2C(g) + xD(g) ����ƽ��ʱ������2 mol C��D��Ũ��Ϊ0��5 mol��L��1�������ж���ȷ���ǣ� ��
2C(g) + xD(g) ����ƽ��ʱ������2 mol C��D��Ũ��Ϊ0��5 mol��L��1�������ж���ȷ���ǣ� ��
| A��X��2 |
| B��ƽ��ʱ��������ܶ����� |
| C��ƽ��ʱB��Ũ��Ϊ1��5 mol��L��1 |
| D����A��B������Ӧ����Ϊ3:1ʱ�÷�Ӧ�ﵽƽ�� |
��ѧ�г���ͼ��ֱ�۵�������ѧ��Ӧ�Ľ��̻���������ͼ��������ȷ���ǣ� ��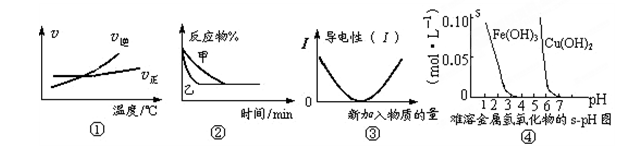
A������ͼ�ٿ��жϿ��淴ӦA2(g)+3B2(g) 2AB3(g)�Ħ�H��0 2AB3(g)�Ħ�H��0 |
B��ͼ�ڱ�ʾѹǿ�Կ��淴Ӧ2A(g)+2B(g) 3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�� 3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�� |
| C��ͼ�ۿɱ�ʾ������Һ��ͨ�백����������������Һ�����Եı仯 |
| D������ͼ�ܣ�����ȥCuSO4��Һ�е�Fe3+�ɲ�������Һ�м�������CuO����pHԼΪ4 |
�����ǹ�ҵ����ȡ�ϳɰ�ԭ����������һ����Ҫ��Ӧ��CO(g)��H2O(g) CO2(g)��H2(g) ��H��0 ���÷�Ӧ�ﵽƽ���Ϊ���CO��ת���ʣ����д�ʩ����ȷ����
| A������ѹǿ | B�������¶� | C������CO��Ũ�� | D���������� |
��һ�������£���һ���������ܱ������г���2mol NO2���������з�Ӧ2NO2��g��  N2O4��g�� ��H �� 0���ﵽƽ��״̬����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ϵ��ͼ�����ж�t1ʱ�̸ı��������Ʋ�����ȷ����
N2O4��g�� ��H �� 0���ﵽƽ��״̬����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ϵ��ͼ�����ж�t1ʱ�̸ı��������Ʋ�����ȷ����
| A������ѹǿ���䣬���߷�Ӧ�¶� |
| B�������¶Ⱥ�����������䣬����1mol N2��g�� |
| C�������¶Ⱥ�����������䣬����1mol N2O4��g�� |
| D�������¶Ⱥ�ѹǿ���䣬����1mol N2O4��g |
����ͬ�¶��£������Ϊ1 L���ĸ��ܱ������У������¶Ⱥ��ݻ����䣬�����ֲ�ͬ��Ͷ�Ϸ�ʽ���з�Ӧ��ƽ��ʱ�й���������(��֪2SO2(g)��O2(g) 2SO3(g)��H����196.6 kJ·mol��1)��
2SO3(g)��H����196.6 kJ·mol��1)��
| ���� | �� | �� | �� | �� |
| ��ʼͶ���� | 2 mol SO2��1 mol O2 | 1 mol SO2��0.5 mol O2 | 2 mol SO3 | 2 mol SO2��2 mol O2 |
| ��Ӧ�ų������յ�����(kJ) | a | b | c | d |
| ƽ��ʱc(SO3) (mol·L��1) | e | f | g | h |
���й�ϵ��ȷ����(����)
A��a��c��e��g B��a>2b��e>2f C��a>d��e>h D��c��98.3e>196.6
 2C(g)�ﵽƽ���־����
2C(g)�ﵽƽ���־���� xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ���ǣ� ��
xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ���ǣ� ��