题目内容
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | pH=1的溶液中:Na+、ClO?、SO42?、I? | |
| B. | c(OH-)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 中性溶液中:Fe3+、K+、Cl?、SO42? | |
| D. | 无色溶液中:Fe2+、NH4+、SCN-、SO42- |
分析 A.pH=1的溶液呈强碱性,弱酸根离子不能大量共存,离子之间反应的不能大量共存;
B.c(OH-)=1×10-13mol/L的溶液呈强酸性;
C.铁离子在中性条件下生成氢氧化铁沉淀;
D.无色溶液中不含有色离子.
解答 解:A.pH=1的溶液呈强碱性,弱酸根离子不能大量共存,酸性条件下ClO?、I?发生氧化还原反应而不能大量共存,故A错误;
B.c(OH-)=1×10-13mol/L的溶液呈强酸性,离子之间不反应且和氢离子不反应,所以能大量共存,故B正确;
C.铁离子在中性条件下生成氢氧化铁沉淀,所以铁离子不能大量共存,故C错误;
D.无色溶液中不含有色离子,Fe2+呈浅绿色,不符合无色条件,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应、氧化还原反应,注意结合限制性条件分析解答,易错选项是C.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
4.某化学反应中生成物的总能量为80kJ,如果该反应是吸热反应,那么反应物的总能量可能是( )
| A. | 120kJ | B. | 100kJ | C. | 90kJ | D. | 60kJ |
5.下列说法正确的是( )
| A. | 石油分馏和煤的液化均为物理变化 | |
| B. | 石油裂解的目的是为了提高汽油等轻质油的产量和质量 | |
| C. | 石油分馏实验中,温度计水银球插入石油中但不能碰到瓶壁 | |
| D. | 煤干馏得到的煤焦油中可以分离出苯、甲苯等有机物 |
13.某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制 0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,配制溶液需要用250ml容量瓶,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)a b e.
Ⅱ.测定中和热的实验装置如图所示

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中平均温度差的空格:
②近似认为0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容
c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(保留小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填序号)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④已知强酸与强碱在稀溶液里反应的中和热可表示为
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1对下列反应:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-Q1 kJ•mol-1
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-Q2 kJ•mol-1
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-Q3 kJ•mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是A
A.Q2>Q3>Q1 B.Q2>Q1>Q3 C.Q1=Q2=Q3 D.Q2=Q3>Q1.
Ⅰ.配制 0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,配制溶液需要用250ml容量瓶,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 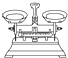 | 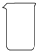 |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中平均温度差的空格:
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 请填写(4.0℃ ) |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(保留小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填序号)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④已知强酸与强碱在稀溶液里反应的中和热可表示为
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1对下列反应:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-Q1 kJ•mol-1
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-Q2 kJ•mol-1
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-Q3 kJ•mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是A
A.Q2>Q3>Q1 B.Q2>Q1>Q3 C.Q1=Q2=Q3 D.Q2=Q3>Q1.
20.下列有关气体的叙述中,正确的是( )
| A. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| B. | 只有在标准状况下,气体的摩尔体积才能约是22.4L•mol-1 | |
| C. | 一定温度和压强下,各种气态物质的体积大小由构成气体的分子大小决定 | |
| D. | 一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定 |
17.2015年2月28,前央视记者柴静的雾霾调查纪录片《穹顶之下》在各大社交网站上热播.该片极大地激发了人们对环境问题的关注和忧虑.下列有关环境问题的说法中正确的是( )
| A. | 煤、石油等化石燃料燃烧过程中排放的废气是形成酸雨的主要原因,酸雨指的是PH值小于7的雨水 | |
| B. | 煤和石油都属于一级能源而天然气属于二级能源 | |
| C. | 在煤中添加适量的石膏可减少燃烧过程中含硫化合物的排放从而减少污染 | |
| D. | 雾霾可能是许多细小液体和固体微粒分散到空气中形成的一种气溶胶 |
14.下列各组原子中,化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子 | |
| C. | 2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |