题目内容
一定温度下,在某2 L恒容密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)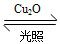 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
下列说法正确的是( )
A.达到平衡时,需要从外界吸收的能量为0.968 kJ
B.前20 min内的平均反应速率v(H2O)=2.5×10-5mol·L-1·min-1
C.增大c(H2O),可以提高水的分解率
D.使用颗粒更小的纳米级Cu2O,可以增大平衡时O2的体积分数
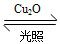 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法正确的是( )
A.达到平衡时,需要从外界吸收的能量为0.968 kJ
B.前20 min内的平均反应速率v(H2O)=2.5×10-5mol·L-1·min-1
C.增大c(H2O),可以提高水的分解率
D.使用颗粒更小的纳米级Cu2O,可以增大平衡时O2的体积分数
A
根据表中信息知,达平衡时生成的n(O2)=0.002 0 mol,则达平衡时吸收的热量是484 kJ·mol-1×0.002 0 mol=0.968 kJ,A项正确;B项,v(O2)=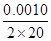 =2.5×10-5 mol·L-1·min-1,则 v(H2O)=2v(O2)=5×10-5 mol·L-1·min-1,B项错误;增大H2O的浓度,H2O的转化率降低,C项错误;催化剂只能加快反应速率,不能使平衡移动,D项错误。
=2.5×10-5 mol·L-1·min-1,则 v(H2O)=2v(O2)=5×10-5 mol·L-1·min-1,B项错误;增大H2O的浓度,H2O的转化率降低,C项错误;催化剂只能加快反应速率,不能使平衡移动,D项错误。
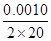 =2.5×10-5 mol·L-1·min-1,则 v(H2O)=2v(O2)=5×10-5 mol·L-1·min-1,B项错误;增大H2O的浓度,H2O的转化率降低,C项错误;催化剂只能加快反应速率,不能使平衡移动,D项错误。
=2.5×10-5 mol·L-1·min-1,则 v(H2O)=2v(O2)=5×10-5 mol·L-1·min-1,B项错误;增大H2O的浓度,H2O的转化率降低,C项错误;催化剂只能加快反应速率,不能使平衡移动,D项错误。
练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
 CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
 2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据: 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。 v(NH3)=v(O2)
v(NH3)=v(O2)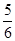 v(O2)=v(H2O)
v(O2)=v(H2O)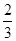 v(NH3)=v(H2O)
v(NH3)=v(H2O) 3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( ) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表: