题目内容
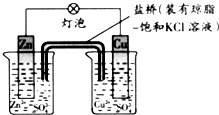 铜锌原电池工作时,下列叙述正确的是( )
铜锌原电池工作时,下列叙述正确的是( )| A、正极反应为:Zn-2e-=Zn2+ |
| B、在外电路中,电子从铜片流向锌片 |
| C、电池反应为:Zn+Cu2+=Zn2++Cu |
| D、盐桥中的K+移向ZnSO4溶液 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,锌为负极,发生氧化反应,铜为正极,发生还原反应,原电池工作时,阳离子向正极移动,阴离子向负极移动,电子从负极经外电路流向正极,以此解答该题.
解答:
解:A.锌为负极,负极反应为Zn-2e-=Zn2+,正极反应为Cu2++2e-=Cu,故A错误;
B.电子从负极经外电路流向正极,即由锌极经外电路流向铜极,故B错误;
C.电池反应原理为锌与硫酸铜溶液反应置换铜,电池总反应为Zn+Cu2+═Zn2++Cu,故C正确;
D.盐桥中阳离子流向正极,阴离子流向负极,即盐桥中的K+移向CuSO4溶液,故D错误.
故选C.
B.电子从负极经外电路流向正极,即由锌极经外电路流向铜极,故B错误;
C.电池反应原理为锌与硫酸铜溶液反应置换铜,电池总反应为Zn+Cu2+═Zn2++Cu,故C正确;
D.盐桥中阳离子流向正极,阴离子流向负极,即盐桥中的K+移向CuSO4溶液,故D错误.
故选C.
点评:本题考查原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度中等,注意把握原电池的工作原理.

练习册系列答案
相关题目
下列除杂方案正确的是(括号内为除杂剂)( )
| A、NaOH溶液中混有Ba(OH)2(K2SO4) |
| B、NaCl溶液中混有Na2CO3(盐酸) |
| C、CO中混有CO2(炽热的炭) |
| D、CO2中混有HCl气体(NaOH溶液) |
下列说法正确的是( )
| A、糖类、油脂、蛋白质在一定条件下都能发生水解反应 |
| B、乙烯使溴的四氯化碳溶液褪色的反应,反应类型为取代反应 |
| C、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D、苯和液溴在FeBr3催化作用下的反应,反应类型为取代反应 |
下列氧化还原反应电子得失情况表示正确的是( )
A、 |
B、 |
C、 |
D、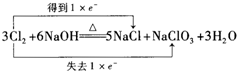 |
欲使每20个水分子中溶有1个钠离子,则180mL水中应投入金属钠的质量约为( )
| A、11g | B、11.5g |
| C、22g | D、23g |
化学与生产、生活密切相关.下列叙述正确的是( )
| A、从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、14C可用于文物年代的鉴定,14C与12C互为同素异形体 |
| D、淀粉、油脂和蛋白质都是天然高分子化合物 |
某原电池的结构如图所示,下列有关该原电池的说法正确的是( )
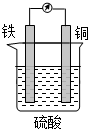

| A、该电池工作时电能转变为化学能 |
| B、铜片的质量增加 |
| C、H+向铁片移动 |
| D、铁片上发生的反应是Fe-2e-═Fe2+ |
下列说法不正确的是( )
| A、漂白粉长时间露置空气中会变质失效 |
| B、澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C、高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D、金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
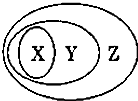 用如图表示的一些物质或概念间的从属关系中,正确的是( )
用如图表示的一些物质或概念间的从属关系中,正确的是( )