题目内容
已知NH4+与HCHO在水溶液中发生如下反应:4NH4++6HCHO→(CH2)6N4+4H++6H2O。现有某一铵盐,为测定其氮的质量分数,称取铵盐样品m g,溶于水后,再加入足量HCHO溶液配成100 mL溶液。充分反应后,从中取出V1 mL溶液,用c mol·L-1的NaOH溶液进行中和滴定,恰好用去V2 mL。试求该铵盐中氮元素的质量分数为:
A. | B. | C.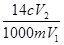 | D. |
D
解析试题分析:根据反应式4NH4++6HCHO→(CH2)6N4+4H++6H2O、OH-+H+=H2O可知:
NH4+~~~OH-
1mol 1mol
n 0.001V2cmol
所以原样品中NH4+的物质的量= ×0.001V2cmol
×0.001V2cmol
因此样品中氮原子的质量= ×0.001V2cmol×14g/mol=
×0.001V2cmol×14g/mol=
所以该铵盐中氮元素的质量分数为 ,答案选D。
,答案选D。
考点:考查铵盐中氮元素质量分数的计算

 备战中考寒假系列答案
备战中考寒假系列答案25 ℃时,在PbI2饱和溶液中,存在着平衡PbI2(s) Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
| A.溶液中Pb2+和I-浓度都增大 | B.溶度积常数Ksp不变 |
| C.沉淀溶解平衡不移动 | D.溶液中Pb2+和I-浓度不变 |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.pH=8.3的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C.常温下,pH=2的盐酸溶液中,由水电离出的c(H+)=1.0×10-12 mol/L |
| D.Na2CO3溶液中加水稀释后恢复至原温度,pH和Kw均减小 |
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
| A.HX、HY、HZ | B.HZ、HY、HX |
| C.HX、HZ、HY | D.HY、HZ、HX |
100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,将pH=8的Ba(OH)2溶液V1L与pH=5,V2 L NaHSO4混合(忽略溶液体积变化),所得溶液pH=7,则V1:V2=( )
| A.1:9 | B.1:1 | C.2:9 | D.1:2 |
牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:( )
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37 mol9·L-9
5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37 mol9·L-9
下列说法错误的是( )
| A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿 |
| B.由上述平衡可知,小孩长牙时要少吃糖多补钙 |
| C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大 |
| D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s)[Ca5(PO4)3F(s)的Ksp = 2.8×10-61 mol9·L-9] |
在不同温度下,水溶液中c(H+)与c(OH—)有如图所示的关系,下列说法中不正确的是
| A.图中T>25 |
| B.b点溶液c(H+)一定比a点大 |
| C.c点对应的溶液中可能大量存在Al3+、Cl— |
| D.d点对应的溶液呈碱性 |