题目内容
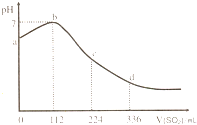
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是
- A.ab 段反应是:SO2+2H2S→3S↓+2H2O
- B.b 点对应的溶液导电性最差
- C.原H2S溶液的物质的量浓度为0.05 mol?L-1
- D.相同条件下,酸性强弱:亚硫酸>氢硫酸
C
分析:H2S 饱和溶液中通入SO2,发生SO2+2H2S=3S↓+2H2O,当溶液的pH等于7时呈中性,当溶液的pH大于7时呈碱性.当溶液的pH小于7时呈酸性;当溶液的pH小于7时,随着pH的减小酸性增强,当溶液的pH大于7时,随着pH的增大碱性增强,以此来解答.
解答:A.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S→3S↓+2H2O,故A正确;
B.b点为中性,只有水,导电性最差,故B正确;
C.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)=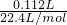 =0.005mol,n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为
=0.005mol,n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为 =0.1mol/L,故C错误;
=0.1mol/L,故C错误;
D.由图可知,后来为亚硫酸溶液,亚硫酸的pH更小,则酸性更强,即相同条件下,酸性强弱:亚硫酸>氢硫酸,故D正确;
故选C.
点评:本题考查二氧化硫的性质,明确发生的化学反应是解答的关键,注意酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论,题目难度不大.
分析:H2S 饱和溶液中通入SO2,发生SO2+2H2S=3S↓+2H2O,当溶液的pH等于7时呈中性,当溶液的pH大于7时呈碱性.当溶液的pH小于7时呈酸性;当溶液的pH小于7时,随着pH的减小酸性增强,当溶液的pH大于7时,随着pH的增大碱性增强,以此来解答.
解答:A.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S→3S↓+2H2O,故A正确;
B.b点为中性,只有水,导电性最差,故B正确;
C.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)=
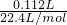 =0.005mol,n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为
=0.005mol,n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为 =0.1mol/L,故C错误;
=0.1mol/L,故C错误;D.由图可知,后来为亚硫酸溶液,亚硫酸的pH更小,则酸性更强,即相同条件下,酸性强弱:亚硫酸>氢硫酸,故D正确;
故选C.
点评:本题考查二氧化硫的性质,明确发生的化学反应是解答的关键,注意酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
相关题目
 标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )| A、ab 段的反应是:SO2+2H2S=3S↓+2 H2O | B、b 点对应的溶液导电性最强 | C、原H2S溶液的物质的量浓度为0.1mol?L-1 | D、bd段对应的溶液呈酸性的原因是:H2SO3=2H++SO32- |
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( ) 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是
