题目内容
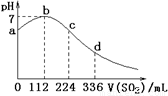
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是![]() 学科网
学科网
A.ab 段的反应是:SO2 + 2H2S=3S↓+2 H2O ![]() 学科网
学科网
B.b 点对应的溶液导电性最强![]() 学科网
学科网
C.原H2S溶液的物质的量浓度为0.1mol·L-1 ![]() 学科网
学科网
D.bd段对应的溶液呈酸性的原因是:H2SO3 = 2H+ + SO32-![]() 学科网
学科网
AC
解析:
本题考查H2S与SO2的反应过程的分析,属中档题。从a到b,pH值在升高,这是由于SO2与H2S反应生成S和H2O,离子浓度在减小,故导电能力在减弱,故A项正确、B项错;由图像知,加入0.005molSO2时,H2S刚好反应,由方程式知,原溶液中H2S为0.01mol,对应浓度为0.1mol·L-1,C项正确;D项应为可逆号。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
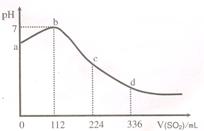
 标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )| A、ab 段的反应是:SO2+2H2S=3S↓+2 H2O | B、b 点对应的溶液导电性最强 | C、原H2S溶液的物质的量浓度为0.1mol?L-1 | D、bd段对应的溶液呈酸性的原因是:H2SO3=2H++SO32- |
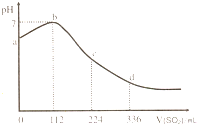
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )