题目内容
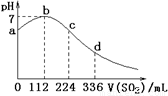
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )。

A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
【答案】
A
【解析】SO2具有氧化性,而H2S具有还原性,二者发生氧化还原反应,方程式为SO2+2H2S===3S↓+2H2O,所以开始阶段pH试管,A正确;根据图像二者恰好反应时,消耗SO2水112ml,则H2S是0.01mol,所以浓度是0.1mol/L,C不正确;当H2S完全被氧化后,再通入SO2,则SO2和水反应生成亚硫酸,溶液当酸性增强,因此BD不正确,答案选A。

练习册系列答案
相关题目
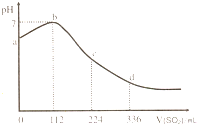 标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )| A、ab 段的反应是:SO2+2H2S=3S↓+2 H2O | B、b 点对应的溶液导电性最强 | C、原H2S溶液的物质的量浓度为0.1mol?L-1 | D、bd段对应的溶液呈酸性的原因是:H2SO3=2H++SO32- |
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )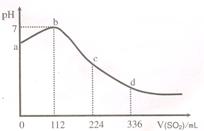 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是