题目内容
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
C
(1)N2(g)+2O2(g)=2NO2(g) ΔH="+67.7kJ/mol," ;(2)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,根据盖斯定律,[(1)+(2)]/2知,A错;N2H4不能电离得到OH-,B错;根据负极反应原理及碱性环境,C正确;铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,OH-的物质的量不变,但生成水,所以KOH溶液的pH减少。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目


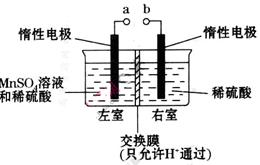
 个,左室溶液中
个,左室溶液中 的变化量为________________。
的变化量为________________。

 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
 2HI(g) △H = -9.48 kJ/mol
2HI(g) △H = -9.48 kJ/mol Ba(OH)2(aq)+HCl(aq)=
Ba(OH)2(aq)+HCl(aq)=