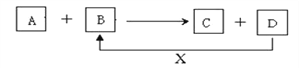
题目内容
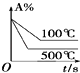
【题目】下列描述中,不符合生产实际的是( ) 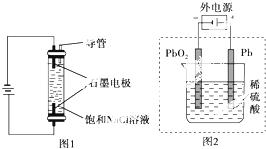
A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
B.在镀件上电镀锌,用锌作阳极
C.用如图1装置生产家用消毒液(NaClO)
D.用如图2装置为铅蓄电池充
【答案】D
【解析】解:A.加热促进盐的水解,而且盐酸为挥发性酸,制备AlCl3、FeCl3、CuCl2发生水解生成盐酸,所以不能采用将溶液直接蒸干的方法,故A正确;B.电镀时镀层金属作阳极,待镀金属作阴极,所以在镀件上电镀锌,用锌作阳极,故B正确;
C.生产家用消毒液(NaClO)的原理是让电解氯化钠溶液生成的氯气和氢氧化钠之间发生反应即可,氯离子在阳极失电子生成氯气,阴极上氢离子得电子生成氢气和氢氧根离子,氯气与氢氧根离子反应生成次氯酸钠,故C正确;
D.充电时,外接电源的正极与铅蓄电池的正极相连,PbO2为正极应该与正极相连,故D错误.
故选D.

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:
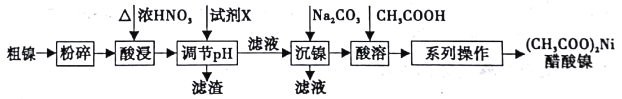
已知:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________。
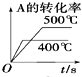
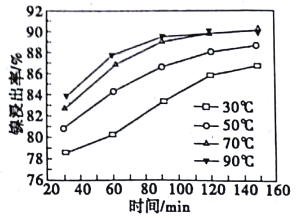
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____℃、_____min。
(3)酸浸中Ni和浓硝酸反应的化学方程式为___________。
(4)加人试剂X为_____(填下列提供试剂的序号),可调节溶液pH至______(填pH范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)=2.0mol/L,若要处理1L该滤液使Ni2+完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2位有效数字)
【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。