题目内容
【题目】以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:
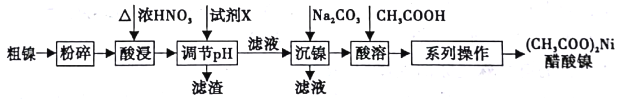
已知:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________。
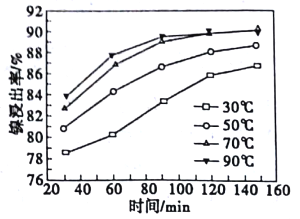
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____℃、_____min。
(3)酸浸中Ni和浓硝酸反应的化学方程式为___________。
(4)加人试剂X为_____(填下列提供试剂的序号),可调节溶液pH至______(填pH范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)=2.0mol/L,若要处理1L该滤液使Ni2+完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2位有效数字)
【答案】 增大固体接触面积,加快酸浸的速率 70 120 Ni+4HNO3(浓)=Ni(NO3)2+2NO2↑+2H2O C 5.6-6.9 313.76
【解析】(1)将原料粉碎可增大固体接触面积,加快酸浸的速率;(2)由图像可知,在70℃时,反应到120min镍浸出率较高;(3)根据流程中信息可知,镍与浓硝酸反应可生成Ni2+,浓硝酸被还原生成NO2,故反应方程式为:Ni+4HNO3(浓)=Ni(NO3)2+2NO2↑+2H2O;(4)加入试剂X需中和溶液中过量的硝酸,并调节溶液的pH至5.6-6.9范围,让溶液中的Fe3+、Cr3+转化为Fe(OH)3、Cr(OH)3沉淀,故试剂X可用NaOH,答案选C;(5)要让1L c(Ni2+)=2.0 mol· L-1的溶液中Ni2+完全反应需n(CO32-)=CV=2.0 mol· L-1×1L=2mol。要使溶液中c(Ni2+)≤10-5mol·L-1,需c(CO32-)=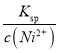 =
=![]() =0.96 mol·L-1。故加入的碳酸钠的总物质的量为2mol+0.96mol=2.96mol,其质量为2.96mol ×106g/mol=313.76g。
=0.96 mol·L-1。故加入的碳酸钠的总物质的量为2mol+0.96mol=2.96mol,其质量为2.96mol ×106g/mol=313.76g。

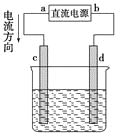
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
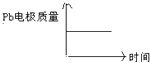
D |
|
|
A.A
B.B
C.C
D.D