��Ŀ����
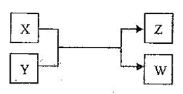
����Ŀ��X��Y��Z��W���������������ת����ϵ�����и�X��WΪ���ʣ�Y��ZΪ�����δ�г���Ӧ��������
��.��Z�������г��õĵ�ζƷ��W��������Һ��������
��ҵ��Z�ж�����;���û�ѧ����ʽ��ʾZ��һ����;��________________��
���������õ�Z�����˵���أ�����X��Y��Һ��Ӧʱ���Եõ�һ�ֵ����Σ��˷�Ӧ�����ӷ���ʽ��________________��
��.��X�ǹ�ҵ���������Ľ������ʣ�Z��һ�־��д��Եĺ�ɫ���壬��:
��1��X��Y��Ӧ�Ļ�ѧ����ʽ��________________��
��2����������װ��ֻ����Z+W��X+Y��Ӧ���г�װ��δ��������
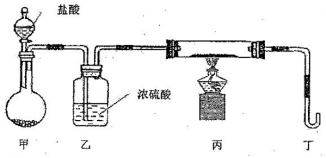
����ɴ�ʵ���жಽ���������������ǣ�
A����ȼ�ƾ��� B���μ����� C���������崿��
�������������Ⱥ�˳���� ������ĸ����
��Ϊ��֤ʵ��ɹ�������װ����Ҫ�Ľ����������������������� ��
��3����3.38gZ����50ml4mol/L ϡHNO3�г�ַ�Ӧ������112ml��NO����״��������Ӧ�����Һ�еμ�NaOH��Һ�ܲ��������������������ʱ��������Ҫ����2mol/L��NaOH��Һ__________ml.����ȷ��0.1����
���𰸡���: ��1��2 NaCl +2H2O![]() H2��+ Cl2�� + 2NaOH ��
H2��+ Cl2�� + 2NaOH ��
��2��3Cl2+I-+3H2O��6Cl-+IO3-+6H+��
������1��3Fe+4H2O![]() Fe3O4+4H2��
Fe3O4+4H2��
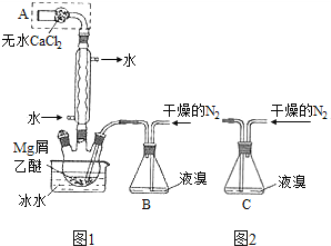
��2����b c a �����ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ����3��97.5��
��������
���������I����1��W��������Һ�������Ƴ�WΪI2��XΪ���ʣ���Z������õ�ζƷ�����XΪCl2��YΪNaCl���ٵ�ⱥ��ʳ��ˮ���õ�NaOH��H2��Cl2����Ӧ����ʽΪ��2 NaCl +2H2O![]() H2��+ Cl2�� + 2NaOH �������ƼNaCl��CO2��NH3��H2O=NaHCO3����NH4Cl����Cl2�������������ϼ���0������1��,KI��I�ɣ�1������5�ۣ����ݻ��ϼ۵�������������ƽ��������ӷ�Ӧ����ʽΪ��3Cl2+I��+3H2O��6Cl��+IO3��+6H����II.X�ǹ�ҵ���������Ľ������ʣ�XΪ����Z��һ�־��д��Եĺ�ɫ���壬ZΪFe3O4����1�������ķ�Ӧ������ˮ�����ķ�Ӧ���䷴Ӧ����ʽΪ��3Fe+4H2O
H2��+ Cl2�� + 2NaOH �������ƼNaCl��CO2��NH3��H2O=NaHCO3����NH4Cl����Cl2�������������ϼ���0������1��,KI��I�ɣ�1������5�ۣ����ݻ��ϼ۵�������������ƽ��������ӷ�Ӧ����ʽΪ��3Cl2+I��+3H2O��6Cl��+IO3��+6H����II.X�ǹ�ҵ���������Ľ������ʣ�XΪ����Z��һ�־��д��Եĺ�ɫ���壬ZΪFe3O4����1�������ķ�Ӧ������ˮ�����ķ�Ӧ���䷴Ӧ����ʽΪ��3Fe+4H2O![]() Fe3O4+4H2����2���������ǿ�ȼ�����壬��Ҫ�ų�װ���п�������ֹ����Σ�գ���Ҫ���������Ĵ��ȣ��ڵ�ȼ�ƾ��ƣ���˲�����bca����������лӷ��ԣ������л���HCl����ʵ��������ţ������ȥ������HCl������ˮ������ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ����3���������ʱ����Һ������ֻ��NaNO3������Ԫ���غ㣬n��NaOH�� = n��NaNO3�� = ��50 �� 10��3 �� 4 �� 112 �� 10��3 /22.4�� mol = 0.195 mol��v��NaOH�� = 0.195/2L = 0.0975L,��97.5ml��
Fe3O4+4H2����2���������ǿ�ȼ�����壬��Ҫ�ų�װ���п�������ֹ����Σ�գ���Ҫ���������Ĵ��ȣ��ڵ�ȼ�ƾ��ƣ���˲�����bca����������лӷ��ԣ������л���HCl����ʵ��������ţ������ȥ������HCl������ˮ������ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ����3���������ʱ����Һ������ֻ��NaNO3������Ԫ���غ㣬n��NaOH�� = n��NaNO3�� = ��50 �� 10��3 �� 4 �� 112 �� 10��3 /22.4�� mol = 0.195 mol��v��NaOH�� = 0.195/2L = 0.0975L,��97.5ml��

 ����������������ϵ�д�
����������������ϵ�д�