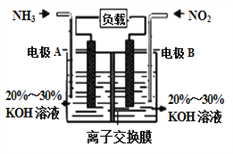
��Ŀ����
����Ŀ��A��B��C��D��E5���������ǿ�����ԭ�ӻ����ӣ�����������ǵ�Ԫ�ص�ԭ��������С��18��A���������������ȴ�����5��������ԭ��B��ԭ�Ӻ�����������ǰһ���ڵ�ͬ��Ԫ�ض�8�����䵥�ʲ��ܴ�CuSO4��Һ���û���Cu��CԪ����3��ͬλ�أ�C1��C2��C3��C1���������ֱ�ΪC2��C3��![]() ��
��![]() ��DԪ�ص���̬�⻯������ˮ���Լ��ԣ�E�������ֲ�ͬԪ����ɵĴ�����ɵ�����������2��ԭ�Ӻ�10�����ӣ�E������C+��ϳ���������
��DԪ�ص���̬�⻯������ˮ���Լ��ԣ�E�������ֲ�ͬԪ����ɵĴ�����ɵ�����������2��ԭ�Ӻ�10�����ӣ�E������C+��ϳ���������
(1)д���������ı�ʾ���ţ�A________��B________��C________��D________��E________��
(2)д��C��ͬλ�����ƣ�C1________��C2________��C3________��
(3)C��D�γɵ�10�����ӵķ��ӵĻ�ѧʽΪ________��
���𰸡� F Na�� H�� N�� OH � � � NH3
��������A���������������ȴ�����5����˵�����ĵ��Ӳ��Ų�Ϊ2��7��ΪF������ԭ��B��ԭ�Ӻ�����������ǰһ���ڵ�ͬ��Ԫ�ص�ԭ�Ӷ�8����˵������Na��Mg��Al�е�һ�֣������ܴ�CuSO4��Һ���û���Cu��˵���������ˮ��Ӧ����BΪNa��CԪ����3��ͬλ�أ�C1��C2��C3��C1���������ֱ�ΪC2��C3��![]() ��
��![]() ��˵����H��3��ͬλ��뭡�뮡�밣�DԪ�ص���̬�⻯������ˮ���Լ��ԣ�˵���ǰ�����DΪN��E������C+��ϳ���������C+ΪH+������EΪOH��
��˵����H��3��ͬλ��뭡�뮡�밣�DԪ�ص���̬�⻯������ˮ���Լ��ԣ�˵���ǰ�����DΪN��E������C+��ϳ���������C+ΪH+������EΪOH��
(1)д���������Ϸ�����֪�������ķ��ŷֱ���F��Na��H��N��OH��(2)C��ͬλ�����Ʒֱ���C1��뭡�C2��뮡�C3��밡�(3)C��D�γɵ�10�����ӵķ��ӵĻ�ѧʽΪNH3��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����һ���¶��£�������X������Y��0.16mol����10L �����ܱ������У�������Ӧ��X��g��+Y��g���T2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������±�������˵����ȷ���ǣ�������
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.��Ӧǰ2min��ƽ�����ʦͣ�Z��=2.0��10��5 mol/��Lmin��
B.4minʱ���ͣ��棩���ͣ�����
C.���¶��£��˷�Ӧ��ƽ�ⳣ��K=1.44
D.7minʱ����Ӧ��δ�ﵽƽ��״̬
����Ŀ����ҵ�ϣ�CH3OHҲ����CO��H2�ϳɣ��ο��ϳɷ�ӦCO��g��+2H2��g��CH3OH��g����ƽ�ⳣ��������˵����ȷ���� ��������
�¶�/�� | 0 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 13 | 1.9��10��2 | 2.4��10��4 | 1��10��5 |
A.�÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ
B.�÷�Ӧ�ڵ����²����Է����У������¿��Է����У�˵���÷�Ӧ��S��0
C.��T��ʱ��1L�ܱ������У�Ͷ��0.1mol CO��0.2mol H2 �� �ﵽƽ��ʱ��COת����Ϊ50%�����ʱ��ƽ�ⳣ��Ϊ100
D.��ҵ�ϲ����Ըߵ�ѹǿ��5MPa����250�棬����Ϊ�������£�ԭ����ת�������
����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
��ʵ�����ݼ���¼��
ʵ���� | ʵ���¶� | �Թ��������Լ���������/mL | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | |||
�� | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
�� | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
�� | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
��1������ɴ�ʵ����ƣ����У�V1=________��V2=__________��
��2��ʵ��١���̽������_____________�Ի�ѧ��Ӧ���ʵ�Ӱ�죬�����ϱ��е�ʵ�����ݣ����Եõ��Ľ�����______________________________________��
��3��̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��________________����ʵ���ţ���
��4������ʵ��1�е����ݣ�������KMnO4��ʾ�Ļ�ѧ��Ӧ����Ϊ__________��
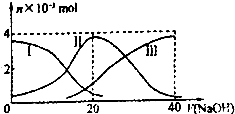
��5����С��ͬѧ���ݾ��������n(Mn2+)��ʱ��仯��������ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n(Mn2+)��ʱ��仯��ʵ��������ͼ2��ʾ��

��С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬���������ʵ�鷽����������ʵ��̽����
ʵ���� | ʵ���¶�/�� | �Թ��������Լ��������� | �����Թ��м���ij�ֹ��� | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | ||||
�� | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
�ٸ�С��ͬѧ����ļ�����__________________________________________��
������С��ͬѧ����ļ��������Ӧ�۲쵽_____________________________����