题目内容
6.98gH2SO4中的物质的量1mol,含6.02×1023个硫原子,1.204×1024个氢原子,4molO.将其配成2L的溶液,其物质的量浓度是0.5mol/L.分析 根据n=$\frac{m}{M}$计算硫酸的物质的量,S原子物质的量等于硫酸物质的量、H原子物质的量等于硫酸的2倍、O原子物质的量等于硫酸的4倍,根据N=nNA计算S原子、H原子数目,根据c=$\frac{n}{V}$计算硫酸溶液的物质的量浓度.
解答 解:98gH2SO4中的物质的量为$\frac{98g}{98g/mol}$=1mol,含有S原子为1mol×1×6.02×1023mol-1=6.02×1023,含有H原子数目为1mol×2×6.02×1023mol-1=1.204×1024,含有O原子物质的量为1mol×4=4mol,将其配成2L的溶液,其物质的量浓度是$\frac{1mol}{2L}$=0.5mol/L,
故答案为:1;6.02×1023;1.204×1024;4;0.5.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心计算,理解化学式意义.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
17.在2L绝热(不与外界交换能量)密闭容器中进行4A (g)+2B (g)?5C (g)+3D (s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高.
①体系压强升高的理由是该反应为放热反应,温度升高气体的压强增大,
②该反应的平衡常数会随温度的降低而增大,(填“增大”“减小”或“无法确定”)理由是表格中起始投料表示反应总体向正反应方向进行,这会使气体的总物质的量减少,但气体的压强反而升高,说明该反应为放热反应,温度降低,平衡向正方向移动,平衡常数增大.
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
②该反应的平衡常数会随温度的降低而增大,(填“增大”“减小”或“无法确定”)理由是表格中起始投料表示反应总体向正反应方向进行,这会使气体的总物质的量减少,但气体的压强反而升高,说明该反应为放热反应,温度降低,平衡向正方向移动,平衡常数增大.
11.下列离子方程式不正确的是( )
| A. | 铁粉投入FeCl3溶液中 Fe+Fe3+=2Fe2+ | |
| B. | 碳酸钙与盐酸反应 CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钠溶液与稀硫酸反应 H++OH-=H2O | |
| D. | 铁与盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
15.下列离子方程式中,错误的是( )
| A. | 铜丝与硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 氧化铝与稀盐酸混合:Al2O3+6H+=2Al3++3H2O | |
| C. | 稀盐酸与氢氧化钠溶液混合:H++OH-=H2O | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=ClO-+Cl-+H2O |
16.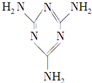 三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )
三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )
 三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )
三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )| A. | 三聚氰胺是一种蛋白质 | B. | 三聚氰胺不是高分子化合物 | ||
| C. | 三聚氰胺分子中含有碳碳双键 | D. | 三聚氰胺的分子式为C3H6N6 |