题目内容
【题目】298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是
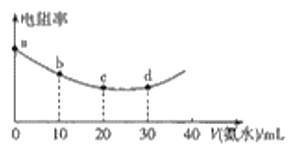
A.电阻率与离子浓度和离子所带电荷有关
B.a、b、c、d四点中,水的电离程度最大的是c
C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-)
D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同
【答案】D
【解析】
A.溶液的导电性与离子浓度和离子所带的电荷有关,溶液的导电性越强,其电阻率越小,故电阻率与离子浓度和离子所带电荷有关,A正确;
B.c点是氨水和叠氮酸恰好完全反应,故此时溶液就是叠氮酸铵,溶液中只有离子的水解,没有氨水或叠氮酸的电离,故对水的电离其促进作用,故a、b、c、d四点中,水的电离程度最大的是c,B正确;
C.c点是氨水和叠氮酸恰好完全反应的时刻,由于NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5,故![]() 的水解程度大于
的水解程度大于![]() 的水解程度,故此时溶液呈弱酸性,继续氨水溶液可能呈中性,故c~d之间可能存在:c(N3-)=c(
的水解程度,故此时溶液呈弱酸性,继续氨水溶液可能呈中性,故c~d之间可能存在:c(N3-)=c(![]() )>c(H+)=c(OH-),C正确;
)>c(H+)=c(OH-),C正确;
D.NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5,二者电离平衡常数略有差别,加上离子的移动速率也是影响电阻率一个因素,故若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水所得曲线不完全相同,D错误;
故答案为:D。

练习册系列答案
相关题目