题目内容
【题目】用下面两种方法均可制得Fe(OH)2白色沉淀.
(1)方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.①用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 .
②除去蒸馏水中溶解的O2常采用的方法.
③制取Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是:防止发生反应 . (填化学方程式)
(2)方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
①在试管Ⅰ里加入的试剂是 .
②为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .
【答案】
(1)稀H2SO4;铁屑;加热煮沸;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2)稀H2SO4、铁屑;检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹
【解析】(1)解:①根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4防止发生水解反应,同时加入铁屑防止硫酸亚铁被氧化.故答案为:稀H2SO4;铁屑;②蒸馏水中若溶有O2 , 则会加速Fe(OH)2氧化,由于氧气的溶解度随温度的升高而减小,因此可采用加热煮沸的方法除去.故答案为:加热煮沸;③用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,是为避免生成的Fe(OH)2沉淀接触O2 , 发生反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 , 故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(2)①铁与硫酸反应生成氢气,关闭止水夹,会使装置Ι中压强变大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,所以在试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,故答案为:稀H2SO4、铁屑;②打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2 . 若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液,故答案为:检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹.(1)①根据FeSO4易被空气中的氧气氧化和易水解的特点分析;②根据气体的溶解度随温度的升高而减小分析;③根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁分析;(2)①根据铁屑与稀H2SO4反应生成硫酸亚铁溶液;②打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2 .

【题目】空气中SO2含量是重要的空气质量指标.
(1)某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10﹣3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
a.取25.00ml的烟道气的水溶液所用仪器名称是
b.滴定终点标志为
c.该厂排放的烟道气中SO2的含量为mg/(L烟道气)
(2)该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
a.该白色浑浊物为 , 产生该现象的原因可能是
b.为了避免产生沉淀,该同学设计了如下实验装置,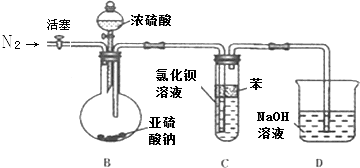
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2 , 其作用是: .
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式 .
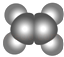
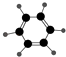
【题目】如表所示的是关于有机物A、B的信息:
A | B |
①能使溴的四氯化碳溶液褪色 | ①由C、H两种元素组成 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的产物的名称为 .
(2)B具有的性质是(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤能使酸性KMnO4溶液和溴水褪色⑥任何条件下均不与氢气反应⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n= , x= .