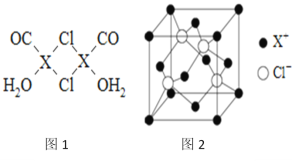
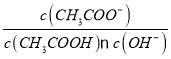题目内容
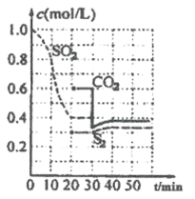
【题目】在两份相同的H2SO4溶液中,分别滴人物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析正确的是( )
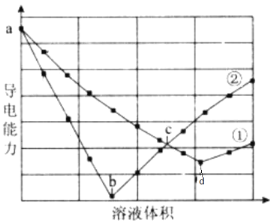
A.①代表滴加Ba(OH)2溶液的变化曲线B.ab段发生反应的离子方程式为:OH-+H+=H2O
C.b、d两点对应的溶液均显中性D.c点对应的两溶液中含有相等量的OH-
【答案】C
【解析】
向H2SO4溶液中滴入Ba(OH)2溶液时,发生反应H2SO4+Ba(OH)2=BaSO4↓+2H2O,随着Ba(OH)2溶液的滴入,溶液中H+、SO42-浓度减小,导电能力逐渐减弱,b点恰好反应时几乎不导电,之后过量的Ba(OH)2使溶液中Ba2+、OH-浓度增大,导电能力增强,故图中曲线②表示向H2SO4溶液中滴入Ba(OH)2溶液;向H2SO4溶液中滴入NaOH溶液时,发生反应H2SO4+2NaOH=Na2SO4+2H2O,随着NaOH溶液的滴入,溶液总体积变大,溶液中离子浓度减小,导电能力逐渐减弱,d点恰好反应时导电能力最弱,之后过量的NaOH使溶液导电能力增强,曲线①表示向H2SO4溶液中滴入NaOH溶液。
A. 根据分析,曲线②在b点溶液导电能力接近0,说明该点溶液离子浓度最小,曲线②表示向H2SO4溶液中滴入Ba(OH)2溶液,A错误;
B. ab 段发生反应的离子方程式为:Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓,B错误;
C. b、d两点,酸碱恰好中和,对应的溶液均显中性,C正确;
D. 曲线②上的c点,Ba(OH)2溶液已经过量,溶液中有OH-,曲线①上的c点,NaOH溶液不足,剩余H2SO4,溶液呈酸性,D错误;
故答案为:C。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】向一个容积为2L的密闭容器中充入2mol NH3和3 mol O2,在恒温和催化剂作用下发生反应:4NH3(g)+5O2(g)4NO(g) + 6H2O(l) ,经过5min后达到平衡状态。此时,c(NH3):c(O2)=4:7。则:
(1)反应开始至平衡时,以NO的浓度变化表示该反应的平均速率v(NO)=__________。
(2)起始状态与平衡状态容器内的压强之比为______。
(3)该条件下反应一段时间,下列能说明反应达到平衡状态的是___________ 。
A.c(H2O)保持不变的状态 B.气体的压强保持不变的状态
C.4v正(NH3)=5v逆(O2) D.NH3与O2浓度之比保持不变的状态
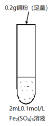
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
A | B | C | D | E | F | |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1 = _________ ,V6 = _________ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________ 。