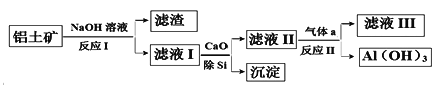
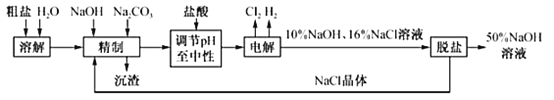
题目内容
【题目】四溴化碳是一种灰白色粉末,熔点为94~95℃,广泛用于有机化合物的溴代、农药的制备等。某合作学习小组的同学拟用丙酮和液溴制备四溴化碳,其原理为CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O。回答下列问题:
Ⅰ.制取Br2
(1)甲组同学拟用溴化钠、二氧化锰及浓硫酸制备液溴,其实验装置如图1所示:
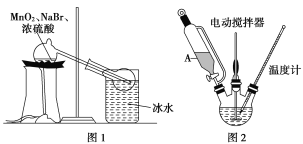
①该装置不用橡皮塞及橡皮管,其原因是___________________;
②冰水的作用是__________________________。
Ⅱ.制取CBr4
(2)乙组同学拟利用甲组同学制得的液溴与CH3COCH3(沸点56.5℃)等试剂制取四溴化碳。实验步骤如下:
步骤1:向图2中三颈烧瓶中加入11.4 g NaOH和46 mL水,搅拌。
步骤2:冰水浴冷却至2℃时,开始不断滴加液溴20 g,滴加完毕后在5℃下保持20 min。
步骤3:加入少量相转移试剂,在不断搅拌下滴入1.6 g丙酮,维持温度在5~10℃,连续搅拌4 h。
步骤4:过滤、冷水洗涤、减压烘干,得产品8.3 g。
①步骤2滴入Br2之前,冷却至2℃的目的是__________________________
②步骤4洗涤时,如何证明已洗涤干净: ___________________________。
③本次实验中产品的产率为______________。
【答案】Br2能腐蚀橡皮塞及橡皮管 冷凝溴蒸气 防止液溴挥发 取少许最后一次洗涤液于试管中,滴入硝酸酸化的AgNO3溶液,若无沉淀生成,则说明已洗涤干净 90.6%
【解析】
(1)根据溴单质容易溶解在有机物中及单质溴在室温下呈液态,容易挥发分析;
(2)①根据溴单质容易挥发的性质分析;
②根据洗涤液中是否含有Br-,滴加AgNO3溶液,看是否产生淡黄色AgBr沉淀判断;
③先计算NaOH、Br2、丙酮的物质的量,根据方程式中物质反应转化关系判断哪种物质过量,然后以不足量的物质为标准计算理论产量,再根据实际产量与理论产量比得到其产率。
(1)Br2容易溶解有机物,因此Br2能腐蚀橡皮塞及橡皮管,故用溴化钠、二氧化锰及浓硫酸制备液溴时不能用橡皮塞及橡皮管;单质溴在室温下呈液态,容易挥发,反应产生的溴蒸气易液化,用冰水可以冷凝溴蒸气使其转化为液态;
(2)①由于溴单质在室温下为液态,沸点低容易气化,所以在以溴单质为原料制取CBr4时,为防止液溴挥发,采用冰水浴冷却至2℃的反应条件;
②在三颈烧瓶中发生反应:CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O,若产品CBr4已经洗涤干净,则洗涤液中不含有Br-,可通过取少许最后一次洗涤液于试管中,向其中滴入硝酸酸化的AgNO3溶液,若无浅黄色沉淀生成,则说明已洗涤干净;
③n(NaOH)= 11.4 g÷40g/mol=0.285mol;n(Br2)= 20 g÷160g/mol=0.125mol;n(丙酮)= 1.6 g÷58g/mol=0.0276mol,三种物质发生反应:CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O,n(丙酮):n(Br2):n(NaOH)= 0.0276mol:0.125mol:0.285mol=1:4.5:10.3,根据方程式中物质反应转化关系可知丙酮不足量,反应产生的CBr4以丙酮为标准计算,则根据方程式中丙酮与CBr4的关系可知:理论上产生CBr4的物质的量是判断哪种物质过量,然后以不足量的物质为标准计算理论产量,再根据实际产量与理论产0.0276mol,质量为m(CBr4)=0.0276mol×332g/mol=9.16g,所以本次实验中产品的产率为(8.3g ÷9.16g)×100%=90.6%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。
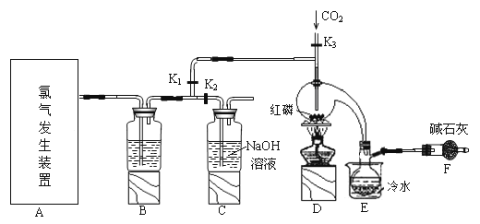
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
请回答下列问题:
(1)请从下图中选择制备氯气的发生装置
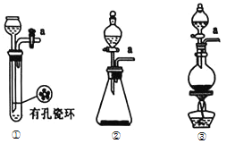
你选用的装置是____(填序号),反应的离子方程式为____。
(2)B中所盛试剂是_____。
(3)E中冷水的作用是____。
(4)仪器F的名称是____;F中碱石灰的作用是___。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过__(填操作名称)即可得到较纯净的PCl3。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/LNa2S2O3溶液8.00mL。
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为___(保留3位有效数字)。