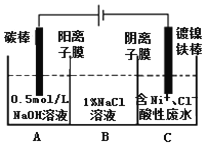
题目内容
【题目】下表是元素周期表的一部分:
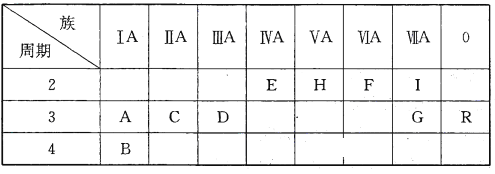
根据要求回答下列问题:
(1)十种元素中化学性质最不活泼的元素是__________________(填元素符号,下同),形成化合物种类最多的元素是_____________________。
(2)A、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是______________(填化学式,下同),E、H、G三种元素的最高价氧化物对应的水化物中酸性最强的是______________。
(3)I元素跟A元素形成化合物的电子式是______________。高温灼烧该化合物时,火焰呈______________色。
(4)分别写出B、G两种单质和水反应的离子方程式_____________、________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式:__________________________________________。
【答案】 Ar C NaOH HClO4 ![]() 黄 2K+2H2O=2K++2OH—+H2↑ Cl2+H2O=Cl—+H++HClO 2Na2O2+2CO2=2Na2CO3+O2
黄 2K+2H2O=2K++2OH—+H2↑ Cl2+H2O=Cl—+H++HClO 2Na2O2+2CO2=2Na2CO3+O2
【解析】
根据元素在周期表中的位置,首先判断出元素种类,然后根据元素周期律并结合有关物质的性质分析解答。
根据元素在周期表中的位置可知A~R分别是Na、K、Mg、Al、C、O、Cl、N、F、Ar。则
(1)十种元素中化学性质最不活泼的元素是稀有气体元素Ar。化合物中最多的是有机物,则形成化合物种类最多的元素是C。
(2)同周期自左向右金属性逐渐减弱,最高价氧化物水化物的碱性逐渐减弱,则A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH;非金属性越强,最高价含氧酸的酸性越强,E、H、G三种元素的最高价氧化物对应的水化物中酸性最强的是高氯酸,化学式为HClO4。
(3)I元素跟A元素形成化合物是NaF,含有离子键的离子化合物,电子式是![]() 。含有钠元素,则高温灼烧该化合物时,火焰呈黄色。
。含有钠元素,则高温灼烧该化合物时,火焰呈黄色。
(4)B、G两种单质分别是钾和氯气,和水反应的离子方程式分别是2K+2H2O=2K++2OH—+H2↑、Cl2+H2O=Cl—+H++HClO。
(5)元素A和F能形成两种化合物,其中较稳定的化合物与CO2反应生成氧气的是过氧化钠,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见下表,下列说法正确的是
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64. 7 | ﹣97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
A. 上述合成反应属于取代反应
B. 间苯三酚与苯酚互为同系物
C. 分离出甲醇的操作是结晶
D. 洗涤时可以用饱和Na2CO3溶液除氯化氢