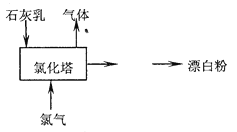
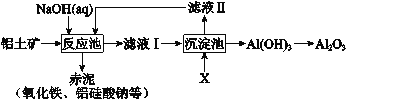
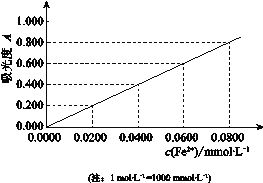
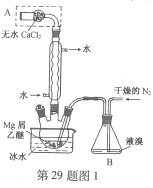
题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.由 D和18O所组成的水11g,所含中子数为4NA
B.1 L 0.4 mol·L-1稀硝酸与Fe完全反应,转移电子数为0.3NA
C.标准状况下,2.24LCHCl3所含分子数为 0.1NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
【答案】B
【解析】
试题分析:A.由 D和18O所组成的水11g的物质的量为:11g/22(gmol-1)=0.5mol,所含中子数为:0.5mol×12=6mol=6NA,故A错误;B.1L 0.4 mol·L-1稀硝酸与Fe完全反应时,假设转移电子的物质的量为x,则做氧化剂的硝酸的物质的量为x/3,起酸性作用的硝酸为3x,所以,3x+x/3=0.4mol,解得x=3,即反应过程中转移电子数为0.3NA,故B正确;C.因为标准状况下CHCl3为液态,所以2.24LCHCl3所含分子数一定大于 0.1NA,故C错误;D.由于存在化学平衡:2NO2![]() N2O4,所以密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数小于2NA,故D错误。
N2O4,所以密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数小于2NA,故D错误。

练习册系列答案
相关题目