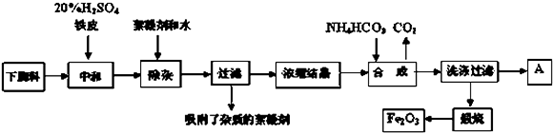
题目内容
1.下列离子方程式正确的是( )| A. | 苏打溶液与稀盐酸反应的离子反应方程式:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 浓烧碱溶液中加入铝片:Al+OH-+H2O═AlO2-+H2↑ |
分析 A.苏打为碳酸钠;
B.发生氧化还原反应生成碘化亚铁、碘和水;
C.石灰水完全反应,生成碳酸钙、碳酸钠和水;
D.电子、原子不守恒.
解答 解:A.苏打溶液与稀盐酸反应的离子反应方程式为CO32-+2H+═CO2↑+H2O,故A错误;
B.Fe2O3与HI的离子反应为Fe2O3+2I-+6H+═2Fe2++I2+3H2O,故B错误;
C.NaHCO3溶液中滴加少量澄清石灰水的离子反应为2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故C正确;
D.浓烧碱溶液中加入铝片的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
12.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
9.用18.4mol/L的浓硫酸配制100ml 1mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中使用仪器的先后顺序排列正确的是( )
| A. | ④③⑦⑤⑥ | B. | ②⑤⑦⑥ | C. | ①③⑤⑥⑦ | D. | ②③⑦⑤⑥ |
16.有一粗硅,含杂质铁,取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等量的H2,则该粗硅中铁和硅的关系正确的是( )
| A. | 物质的量之比为1:1 | B. | 物质的量之比为1:2 | ||
| C. | 质量之比为4:1 | D. | 质量之比为2:1 |
13.日常生活中遇到的很多问题都涉及化学知识,下列有关说法正确的是( )
| A. | 医用酒精和工业酒精的主要成分相同,都可用于伤口消毒 | |
| B. | 人体对食物中蛋白质的消化其实就是使蛋白质发生了水解 | |
| C. | 若两种二肽互为同分异构体,则两者的水解产物不一致 | |
| D. | 棉、麻、蚕丝、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
4. NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
(1)NaClO溶液能杀菌消毒,原因之一是其溶液中存在有效氯(HClO),写出NaClO水解的离子方程式:ClO-+H2O HClO+OH-.
HClO+OH-.
(2)NaClO溶液的杀菌效果与溶液的浓度、温度及溶液中存在的微粒有关.
①不同温度下,500mL 0.1mol?L-1NaClO溶液对1m3空间的杀菌效果如下表所示:
由上表可知,NaClO溶液在40℃时的杀菌效果明显优于20℃时,其原因是升高温度会促进ClO-的水解,使HClO浓度增大,杀菌效果增强.
②下列微粒会减弱NaClO溶液消毒效果的是cd(填字母).
a.NH4+ b.ClO- c.OH- d.SO32-
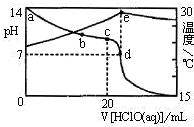
(3)室温下,将1.00mol?L-1的HClO滴入20.00mL 1.00mol?L-1NaOH溶液中,溶液的pH和温度随加入HClO体积的变化曲线如图所示.
①a、b、c、d四点中,水的电离程度最大的是c(填字母).
②下列说法中正确的是AB(填字母).
A.a、b、c、d四点溶液中d点溶液中ClO-的物质的量最大
B.c点溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+)
C.d点溶液中:c(Na+)=c(ClO-)+c(HClO)
D.e点后溶液温度下降的主要原因是HClO电离吸热.
 NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.(1)NaClO溶液能杀菌消毒,原因之一是其溶液中存在有效氯(HClO),写出NaClO水解的离子方程式:ClO-+H2O
 HClO+OH-.
HClO+OH-.(2)NaClO溶液的杀菌效果与溶液的浓度、温度及溶液中存在的微粒有关.
①不同温度下,500mL 0.1mol?L-1NaClO溶液对1m3空间的杀菌效果如下表所示:
| 温度/℃ | 20 | 30 | 40 | 80 |
| 时间/min | 10 | 10 | 10 | 10 |
| 杀菌率 | 83% | 90% | 97% | 92% |
②下列微粒会减弱NaClO溶液消毒效果的是cd(填字母).
a.NH4+ b.ClO- c.OH- d.SO32-
(3)室温下,将1.00mol?L-1的HClO滴入20.00mL 1.00mol?L-1NaOH溶液中,溶液的pH和温度随加入HClO体积的变化曲线如图所示.
①a、b、c、d四点中,水的电离程度最大的是c(填字母).
②下列说法中正确的是AB(填字母).
A.a、b、c、d四点溶液中d点溶液中ClO-的物质的量最大
B.c点溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+)
C.d点溶液中:c(Na+)=c(ClO-)+c(HClO)
D.e点后溶液温度下降的主要原因是HClO电离吸热.
 (1)某学生课外活动小组利用图1所示装置分别做如下实验:
(1)某学生课外活动小组利用图1所示装置分别做如下实验: